LEY DE LOS GASES IDEALES

Los gases ideales es una simplificación de los gases reales que se realiza para estudiarlos de manera más sencilla. En sí es un gas hipotético que considera:
La ecuación del gas ideal se basa condensa la ley de Boyle, la de Gay-Lussac, la de Charles y la ley de Avogadro.
La ecuación del gas ideal se basa condensa la ley de Boyle, la de Gay-Lussac, la de Charles y la ley de Avogadro.
Ecuación de los gases ideales
Ley de Charles
Corresponden a las transformaciones que experimenta un gas cuando la presión es constante. Así tenemos que
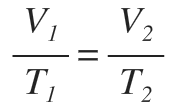


Cuando la temperatura se acerca al cero absoluto, todos los gases tienden al mismo comportamiento.
Ley de Gay-Lussac
Corresponde a las trasformaciones que sufre un gas ideal cuando el volumen permanece constante.


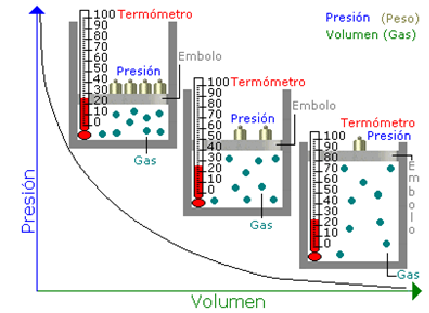
Ley de Boyle
Corresponde a las transformaciones que experimenta un gas cuando su temperatura permanece constante.

La curva que describe el gráfico P versus Volumen, corresponde a una isotérmica, es decir a todos los puntos donde la temperatura es la misma.
Ley de Avogadro
Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas.


Donde:
P= es la presión del gas
V = el volumen del gas
n= el número de moles
T= la temperatura del gas medida en Kelvin
R= la constante de los gases ideales
P= es la presión del gas
V = el volumen del gas
n= el número de moles
T= la temperatura del gas medida en Kelvin
R= la constante de los gases ideales

TAREA
1. REALICE UN MAPA CONCEPTUAL EN SU CUADERNO
2. EN LAS PAGINAS 140 Y 141, EXISTE EJERCICIOS DE GASES. HAGA DIEZ DE ELLOS EN UNA HOJA PERFORADA
3. "QUÉDESE EN CASA POR SU SALUD Y LA DE SU FAMILIA" SALUDOS CORDIALES
No hay comentarios:
Publicar un comentario