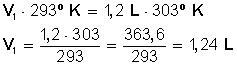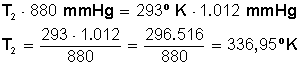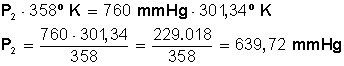Introducción
Ningún
proyecto se
considera completo hasta que se prepara el
informe de
investigación, incluso el estudio más brillante
tiene poco
valor sino se
difunde a la
comunidad
científica.
El informe de investigación representa el
resultado final del largo
proceso de
investigación. Su articulación estructural
constituye ser el modo de como los investigadores ordenan,
clasifican y presentan los
datos.
Cualquiera que sea el tipo de investigación, la
presentación de los resultados se hace con base a
normas que
permiten estructurar de una manera
lógica
la forma y el contenido de la
exposición
teórica. El
objetivo de
esta guía
GUIA METODOLOGICA PARA LA ELABORACIÓN
DE UN INFORME FINAL DE INVESTIGACIÓN con aplicabililidad
al área de la Salud es brindar algunos lineamientos
generales para ayudar al estudiante investigador de las
ciencias de la
salud a comunicar sus resultados. La experiencia que se tiene en
investigación para esta área a mostrado que existe
una limitante en el ámbito estudiantil sobre la
obtención de
modelos o
guías que le permitan presentar los resultados que se han
obtenido en una investigación.
Como su nombre lo dice esta guía viene
estructurada de tal forma para que el estudiante desarrolle paso
a paso el informe final de su investigación.
Básicamente todo informe de investigación
está compuesto por:
Portada, Indice, Introducción, Resumen, Cuerpo del trabajo,
Conclusiones, Recomendaciones, Anexos y la Bibliografía. Sin
embargo a esta guía se le han agregado otros elementos que
complementan la oportuna
comunicación de los resultados.
SUGERENCIAS BÁSICAS PARA LA
PRESENTACIÓN DEL INFORME.
- El trabajo se sugiere que sea elaborado con el mismo
tipo de letra (ARIAL), el tamaño de la letra se
sugiere sea de 12 puntos, color negro y a
doble espacio entre líneas.
-
El papel a
emplear debe de ser tamaño carta, bond,
base 20.
Parte superior 4.0 cm. ( 1 2 pulgadas).
Parte inferior 2.5 cm. ( 1 pulgada).
Parte derecha 2.5 cm. ( 1 pulgada).
Parte izquierda 4.0 cm. ( 1 2 pulgadas).
- Los márgenes del trabajo serán los
siguientes:
- Cada página se numera en la esquina superior
derecha, con números arábigos en el orden
correlativo correspondiente. El número debe aparecer al
menos a 2.5 cm. ( 1 pulgada) de la orilla derecha de la
página, en el espacio entre el borde superior del
documento y la primera línea del texto.
La portada es la parte inicial del informe de
investigación, ésta está compuesta por los
siguientes elementos que van centrados en la página
:
- Nombre de la institución,
- Logo de la Institución.
- Título del informe de
investigación.
- Nombre de autores en orden alfabético. Primero
apellidos y luego nombres.
- Nombre del asesor(es) de contenido.
- Lugar y fecha de presentación.
- EL INDICE
Es un listado de las partes estructurales del informe
de investigación, se coloca después de la portada
y antes de la introducción. Incluye los capítulos
y subcapítulos, temas y subtemas que son y forman parte
de la totalidad de
la investigación.
Se señalan las partes y su numeración de
página correspondiente.
El lector al consultar el índice se pone en
contacto con todo el contenido del escrito, lo cual facilita la
localización de los temas generales y
específicos.
La forma que se sugiere adoptar para el índice
del trabajo de investigación será la llamada
sistema general, en el que se utilizan números
romanos para identificar los capítulos; letras
mayúsculas para los temas, números
arábigos para los subtemas y letras minúsculas
para las subdivisiones de éstos.
ii LA INTRODUCCION
Es la
comunicación inicial que permite (sin necesidad de
explicar) penetrar a detalles incentivadores, creando un
ambiente de
familiaridad y confianza entre el autor del escrito y la
persona
lectora. Además de ser incentivadora, la
introducción presenta el tema de investigación,
los propósitos esenciales y datos generales del
contenido estructural del escrito, es decir una breve
descripción capitular.
Para redactar la introducción deberán
cumplirse las siguientes recomendaciones:
- Redactarla al finalizar el ordenamiento y
clasificación de todos los datos, es decir, cuando se ha
terminado todo el
trabajo.
- Se ubica luego de la tabla de contenidos o
índices.
- Prepara al lector para la descripción de lo
que se hizo.
- Se menciona el tema de investigación y los
objetivos.
Describe el estudio e incluye una breve reseña
bibliográfica, la explicación del marco
conceptual, las hipótesis y la
justificación.
- No se presentan resultados ni
definiciones.
- Debe ser clara y concreta.
- Articular en forma lógica: la
presentación (¿qué es el escrito?,
¿cuál es el título?, ¿a
quién se presentará? y a qué
institución?), el propósito, las partes
estructurales generales y una breve metodología de
exposición.
iii
EL RESUMEN
En él se detalla sintéticamente todo el
contenido del informe de investigación, planteando las
ideas centrales y el perfil del escrito, es decir, reducir a
términos breves y precisos la idea central de la
investigación realizada. Debe incluir la
justificación, objetivo general, principales resultados
y conclusiones. Su extensión varía de las 75
hasta las 150 palabras como máximo.
CAPITULO I
PLANTEAMIENTO DEL
PROBLEMA
Es una breve descripción de la
problemática que puede sustentarse en el desconocimiento
de las causas que la generan, los factores asociados o el grado
de intensidad mostrado en el
comportamiento de algunos
indicadores
o
variables en
un contexto determinado.
Puede subdividirse en los siguientes
apartados:
A.
PROBLEMATICA (Relativa al tema de
estudio)
En este apartado puede plantearse:
- Breves antecedentes de la
problemática.(Antecedentes del
problema)
- Síntomas que la
reflejen.(Situación
Problemática)
- Efectos inmediatos y futuros.
- Causas probables. Factores asociados.
- Datos que verifiquen que el problema es parte de un
contexto en el que se conjugan otros problemas
relativos.
- Actores y/o instituciones involucradas.
- Soluciones que se han intentado.
- Interrogantes fundamentales, preguntas a
responderse en la investigación.(Enunciado del
problema)
Todo lo anterior, redactado en forma lógica y
coherente con un enfoque deductivo; a menos que el tipo de
investigación amerite un enfoque inductivo.
B.
DELIMITACIÓN DE LA
INVESTIGACIÓN.
En este apartado se establecerá
descriptivamente la cobertura que tuvo la investigación
en lo relativo a:
- Espacio geográfico, es decir, el lugar donde
se realizó la investigación.
- Sujetos y/u objetos que participaron en la
realización del estudio.
- Tiempo, especificando el periodo de tiempo en el
que fue realizado la investigación.
- Contenidos, se debe mencionar la o las variables
que se consideraron en el estudio.
- JUSTIFICACIÓN.
Este apartado debe reflejar la importancia y
relevancia que tiene la investigación que se ha
realizado, exponiendo argumentos tales como:
- Evidencias que demuestren la magnitud de la
problemática o necesidad de éstas para
profundizar en el análisis.
- Necesidad de corregir o diseñar medidas
correctivas que contribuyan a la solución de los
problemas expuestos.
- Demostrara que la investigación constituye
una estrategia
para enfrentar la problemática mencionada.
- Mencionar los beneficios futuros que pueden
obtenerse, tanto para las personas como para las
instituciones y/o grupos
sociales.
- LIMITACIONES.
Este apartado debe reflejar las restricciones que
tiene la investigación, para
poder
expandir o generalizar los resultados, así como el
reconocimiento de la incidencias de otras variables que en el
proceso de la investigación no se controlan. Debe
evitarse mencionar limitantes que puedan preveerse antes
de realizar la investigación, tales como tiempo,
costos,
falta de
información y otras propias de los
investigadores.
E.
OBJETIVOS.
- Deben expresarse como proposiciones orientadas a
definir los logros que se esperan obtener a partir de los
resultados que arroje la investigación.
- Los elementos que lo constituyen son el verbo, la
(s) variables, la (s) relaciones y el contexto.
- Deben reflejar lo que se espera obtener al estudiar
cada variable (cuando no se establezca una relación
bivariada), o lo que se espera al estudiar la relación
de dos o más variables.
- Debe formularse un objetivo general y varios
específicos, en donde estos últimos sean
desglosados del primero.
CAPITULO II
FUNDAMENTACIÓN TEORICA.
En este capítulo se exponen algunos
principios,
axiomas o
leyes que rigen
las relaciones de los fenómenos que son parte de la
realidad a estudiar y que de alguna manera están
incidiendo o son parte de la casualidad o
estructura
lógica de las explicaciones teóricas de alguna
disciplina
científica
Este capítulo debe estructurarse dependiendo de
la
naturaleza de
cada investigación, pero en términos generales
deben considerarse aspectos tales como:
- Breve marco histórico.
- Contexto en el que están inmersas las
variables del problema.
- Síntesis del marco social, cultural, legal,
institucional.
- Comportamiento de las variables en otros ambientes
y contextos.
- Enfoques de autores o teorías que las respaldan.
- Relación de las variables.
Todo lo anterior debe plantearse bajo un enfoque
deductivo, es decir desde lo más general hasta lo
más específico, (a menos que el tipo de
investigación demande otro tipo de enfoque).
Así también, cada aspecto debe ser
comentado e interpretado con ideas propias de los
investigadores de manera que se refuercen sus
hipó
tesis. Con
respecto a las referencias bibliográficas se usan las
citas cortas, así: (3,6) ó (Polit, pág.
6), en donde 3 corresponde al tercer
libro de la
bibliografía y 6 corresponde al número de la
página en donde está ese
párrafo textual.
CAPITULO III.
HIPOTESIS Y
VARIABLES.
En este capítulo deben expresarse los supuestos
básicos que orientan la búsqueda de la
información y cómo éstos han sido
operacionalizados a través de la relación
esperada de las variables. De igual manera deben exponerse los
indicadores que permitirán medir el comportamiento de
las variables a evaluar.
Los apartados sugeridos son:
A.
HIPOTESIS.
General y específicas.
En este apartado se sugiere formular las
hipótesis de investigación, tal como estaban en
el
anteproyecto(si
éste se hubiese elaborado). Estas deben correlacionarse
con cada objetivo (solamente cuando la investigación
demande efectuar las respectivas
pruebas). Si
dentro del trabajo no se realizaron pruebas de hipótesis
ya que el estudio es descriptivo o exploratorio, entonces debe
de hacerse esta aclaración.
B.
DIAGRAMA DE VARIABLES.
En este apartado debe presentarse en forma
esquemática, lógica y cronológica, la
relación supuesta entre las variables, definiendo la (s)
independiente (s) y dependiente (s).
C.
DEFINICIÓN OPERACIONAL DE
VARIABLES.
En este apartado debe formularse una definición
de cada una de las variables, tal como deben entenderse en esta
investigación.
D.
INDICADORES DE LAS VARIABLES.
El
concepto de
indicador se refiere a aquellos aspectos medibles que nos
muestran como es el comportamiento de las variables. En el caso
de las variables que representan
procesos, no
se deben definir indicadores que no sean sujetos de
medición.
CAPITULO IV
METODOLOGÍA
DE LA INVESTIGACIÓN.
Este capítulo comprende la descripción
de la estrategia a seguir expresada a través del tipo y
modalidad de la investigación, la caracterización
de las unidades de análisis, las
técnicas, procesos e instrumentos de
medición a ser utilizados; los cuales se
expresarán en los siguientes apartados:
-
Este apartado debe reflejar la manera de cómo
se enfocó la investigación en cuanto al
propósito, amplitud y profundidad, mencionando las
características propias del nivel o
modalidades de investigación que se aplicó en
base a los planteamientos de algunos autores de textos
actualizados. Cuando el tipo de investigación demande
la aplicación de algún diseño, será necesario exponerlo
y explicarlo en cada uno de sus elementos y procesos dentro
de este apartado.
-
TIPO DE INVESTIGACIÓN
Aquí debe describirse detalladamente las
características propias del conglomerado de sujetos u
objetos hacia los cuales se orientó la
investigación, es decir, a la totalidad de elementos
que podrían ser objeto de medición.
Cuando no se trabaje con toda la población,
sino con una parte de ella (muestra),
debe definirse si ésta fue tomada aleatoriamente. En
este caso debe de determinarse un tamaño muestral
calculado mediante probabilidades y niveles de confianza
definidos. Si la selección no fuese aleatoria, debe
justificarse el por qué y reconocer las limitaciones
que esto implica y los criterios que se definieron para
escoger a los sujetos. Para cualquiera de los dos casos, debe
describirse el proceso de selección de los elementos
que conformaron la muestra.
- POBLACIÓN Y MUESTRA
- MATERIALES Y
METODOS
Descripción detallada de cómo fue
realizada la investigación y los elementos utilizados en
la misma. Incluye:
- Detalle de procedimientos: Explicación general
sobre aspectos como número de grupos,
asignación de sujetos a grupos, manipulación,
etc.)
-
En este apartado deben explicarse cada una de las
técnicas que se aplicaron (entrevista, encuesta o
alguna otra), a quiénes se les aplicó, con
qué propósito, cómo se desarrollo, pasos que siguieron, y cuál
fue el uso específico que se le dió a la
información o datos recopilados a través de
éstos.
También deben describirse los instrumentos
que se han utilizado en la investigación, mencionando
cómo es su estructura, su contenido, en qué se
han basado para su construcción, cómo se califican
y ponderan las respuestas y cuál ha sido el proceso de
validación.
-
TECNICAS APLICADAS EN LA RECOLECCIÓN DE LA
INFORMACIÓN. INSTRUMENTOS DE
MEDICIÓN.
En este apartado se debe exponer desde cómo
se tabularon y organizaron los datos, los respectivos cuadros
y gráficos con su respectiva
descripción de los resultados, los modelos
estadísticos y/o programas que
se utilizaron para su exposición, la
justificación del por qué se usaron y
cómo se efectuaron las pruebas de hipótesis en
el caso que se realicen.
-
RESULTADOS.
Autoevaluación de los procedimientos
empleados y discusión de los posibles alcances y
significados de la investigación. Se hace una
interpretación acerca de los resultados obtenidos con
respecto a la información encontrada en la
revisión de la literatura,
evitando hasta dónde sea posible especular.
- DISCUSIÓN DE RESULTADOS.
- CONCLUSIONES.
Las conclusiones en el informe de
investigación, hacen referencia a los resultados
concretos que se obtuvieron en el desarrollo de la
investigación y que fueron presentados ampliamente en el
desarrollo del cuerpo del trabajo, prácticamente es un
resumen sintético de los puntos más importantes y
significativos para los autores. Estas van acorde al numero de
objetivos planteados en la investigación, esto no quiere
decir que no se presentará otra información
importante obtenida durante el estudio.
H
. RECOMENDACIONES.
Las recomendaciones constituyen el aparato del
documento, dónde la
creatividad
del investigador (es) se pone de manifiesto en el planteamiento
de
políticas,
estrategias y
medidas de
acción a tomar por instituciones
(públicas o privadas), requisitos, entidades, etc. para
la solución del problema que se
investigó.
I.
ANEXOS
Aquí se ubicarán los instrumentos y otro
tipo de documento que han sido necesarios para el desarrollo
del trabajo y que no se ha considerado otro lugar para ellos en
el documento.
Los anexos son secciones adicionales que se adjuntan
al documento escrito, el objetivo es presentar
información adicional importante, ya sea para prolongar
la explicación de los datos, como también para
confirmarlos. Se ubica después de las conclusiones y
recomendaciones, antes de la bibliografía.
Ejemplo de anexos: copias de
documentos,
mapas,
planos, cuestionarios, guías de entrevista y
observación,
proyectos,
programas, cuadros, gráficos,
diagramas,
resultados de laboratorios, cronogramas, presentación de
la exposición etc. Dichos
agregados son ordenados de
acuerdo a cómo han sido citados en el cuerpo del
trabajo.
J.
BIBLIOGRAFIA
Es la última parte del informe de
investigación, agrupa todas las
fuentes
consultadas para la realización de la
investigación y
redacción del informe. Las fuentes pueden
ser
libros,
revistas, boletines, periódicos y documentos
varios(referencias electrónicas o de
Internet).
Cuando la bibliografía es utilizada en el
trabajo comprende otras fuentes además de libros, se
dividirán en secciones que se clasifican y ordenan de la
siguiente manera: libros, revistas, boletines,
periódicos, documentos y otras fuentes ( como por
ejemplo la
entrevista, referencias electrónicas o de Internet),
los titulados de estas secciones
irán en
mayúscula en el centro de la página. Lo que se
presenta a continuación es una sugerencia para elaborar
la bibliografía. Sin embargo, se remite a los lectores a
consultar las Normas que la American Psychological Association
(APA), 5°
Edición a elaborado con el objetivo de que
sean consideradas para la elaboración de una
Bibliografía más completa.
Cada fuente se enumera y se ubica en orden
alfabético.
Elementos que componen la
bibliografía:
1. Autor (apellidos y nombres)
2. Título de la obra, subrayado y seguido de
un punto.
3. Número de edición y seguido de una
coma
- Lugar de la edición( ciudad) y seguido de
una coma
- Nombre de la editorial y seguido de una
coma
- Fecha de edición.
Ejemplo:
Ashley, Ruth .
Anatomía y
Terminología Dental, Segunda Edición,
México D.F., Editorial Limusa,
1979.
1. Articulista como autor (punto).
2. Título del artículo (entrecomilladas
y punto).
3. Nombre de la
revista
(subrayado y punto).
4. Lugar de la edición (coma).
5. Editor de la revista.
6. Número de la revista.
7. Fecha de la revista.
8. Página primera y última del
artículo.
Ejemplo:
González, José Roberto. "La
investigación de los factores genéticos en la
enfermedad periodontal". Visión
Odontológica. UEES, San Salvador, C.A.,
número 2, año 5, Junio - Diciembre 2001,
páginas 11 a 16.
1. Nombre del boletín
2. Título del artículo.
3. La palabra Boletín.
4. Lugar, país.
5. Institución responsable.
6. Año.
7. Número.
8. Fecha, página.
Ejemplo:
Boletín de Ciencias Económicas,
Análisis crítico de las diversas interpretaciones
del
subdesarrollo. Punto de vista latinoamericano
Boletín, San Salvador,
El Salvador, C.A.
Universidad
José Simeón Cañas, UCA, año X,
número 1 enero - febrero de 1987. Páginas 37 a
48.
LAS CITAS AL PIE DE PAGINA
1. Utilice las notas o citas al pie de la
página para ampliar, sustentar, definir, especificar
significados, referir autores y sus respectivas obras e
informar.
2. Permiten determinar en cierta forma la capacidad
del investigador, su
pensamiento
con el de otras personas, y los niveles de abstracción
alcanzados.
3. Amplían la información sin
interrumpir la lógica del
discurso.
4. Tipos de cita al pie de páginas más
comunes : las citas resumen, comentarios textuales y de
ampliación.
5. Las locuciones latinas más utilizadas
son:
- IBID, idem, ibídem, equivalen a lo
mismo.
b) OP. CIT. u OPERE CITATO equivale a obra
citada.
c) LOC. CIT. indica lugar citado.
MODO DE UTILIZACION
Cuando se cita por primera vez a un autor:
- Autor (nombre y apellido)
- Título de la obra ( subrayado)
- Página adonde aparece la cita.
- El punto que cierra la cita.
Ejemplo:
1 / Raúl Rojas Soriano. Investigación
social.
Teoría
y práctica.
Págs. 16
IBID o IBIDEM, se utiliza cuando se cita un mismo
autor y una misma obra, variando solamente la página, se
usa para evitar repetir datos de la fuente.
Ejemplo:
2/ Ibídem, pág. 10
Se utiliza IDEM, para identificar el mismo autor, obra y
página.
Ejemplo:
3/IDEM
LOC. CIT. o LOCUS CITATO, indica texto o lugar citado.
Se emplea cuando se repite información del mismo autor,
el mismo libro y las mismas páginas.
Ejemplo:
4/LOC. CIT., página 20.
OP. CIT. u OPERE CITATO, se emplea cuando se cita
más de una vez el mismo autor y obra.
Ejemplo:
1/Ezequiel , Ander-Egg. Repensando la
investigación acción participativa. Pág.
70
2/Soriano, Raúl Rojas. Investigación
social. Teoría y práctica. Página
16
3/Ezequiel, Ander-Egg. OP CIT página
21.
Los ejemplos antes mencionados constituyen aspectos
generales de esta técnica. El objetivo de lo presentado
es que los principiantes en la investigación,
desarrollen los primeros pasos en este amplio y profundo
campo.
BIBLIOGRAFIA.
Hernández, Sampieri. Roberto. Metodología
de la investigación 2a. Edición. Editorial
McGraw-Hill, México, 1998.
Polit, Denise, F. Hungler Bernadette P.
Investigación científica en ciencias
de la salud, 5ta. edición. Mc-Graw Hill Interamericana,
Editores, S.A. México, D.F. 1997.