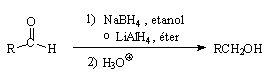Aldehídos y cetonas
Los
aldehídos y las cetonas contienen el grupo funcional carbonilo,

.
Se diferencian entre sí en que en los aldehídos este grupo carbonilo se encuentra
en un extremo de la cadena hidrocarbonada, por lo que tiene un átomo de hidrógeno
unido a él directamente, es decir, que el verdadero grupo funcional es

, que
suele escribirse, por comodidad, en la forma
—CHO.
En cambio, en las cetonas, el grupo carbonilo se encuentra unido a dos radicales
hidrocarbonados: si éstos son iguales, las cetonas se llaman
simétricas,
mientras que si son distintos se llaman
asimétricas. Según el tipo de
radical hidrocarbonado unido al grupo funcional, los aldehídos pueden ser alifáticos,
R—CHO, y aromáticos,
Ar—CHO;
mientras que las cetonas se clasifican en alifáticas,
R—CO—R',
aromáticas,
Ar—CO—Ar,
y mixtas;
R—CO—Ar, según
que los dos radicales unidos al grupo carbonilo sean alifáticos, aromáticos o
uno de cada clase, respectivamente.
Conviene hacer notar que, si bien los
aldehídos y cetonas son los compuestos más sencillos con el grupo carbonilo, hay
otros muchos compuestos que contienen también en su molécula el grupo carbonilo
que, junto a otras agrupaciones atómicas, constituyen su grupo funcional característico.
Entre estos compuestos podemos citar: ácidos carboxílicos,
—CO—OH;
halogenuros de acilo,
—C—X,
ésteres,
—CO—OR, amidas,
—CO—NH2
, etc., sin embargo, el nombre de compuestos carbonílicos suele utilizarse
en sentido restringido para designar exclusivamente a los aldehídos y cetonas.
Nomenclatura
En la nomenclatura sistemática, los
aldehídos se nombran cambiando por
al la
o terminal del nombre
del hidrocarburo correspondiente a la cadena hidrocarbonada más larga que incluya
el grupo funcional
—CHO, al
que se le asigna la posición 1 a efectos de enumerar los posibles sustituyentes.
Los nombres de las cetonas se forman de manera análoga, pero cambiando por
ona
la
o terminal del hidrocarburo progenitor e indicando, si es preciso,
la posición del grupo
—CO— con un número (el más bajo posible).
Las cetonas suelen nombrarse también corrientemente mediante los nombres de los
dos radicales unidos al grupo carbonilo, seguidos de la palabra cetona. Ejemplos:
 |
|  |
4Cloro-2-metilbutanal
|
|
4-ciclohexil-1-fenil-2-pentanona
|
Muchos aldehídos tienen nombres vulgares que derivan
del nombre común del ácido carboxí1ico correspondiente, (formaldehído, acetaldehído,
etc.).
Propiedades físicas
Las propiedades físicas
(y químicas) características de los aldehídos y cetonas están determinadas por
la presencia del grupo funcional carbonilo, en el que existe un enlace doble carbono-oxigeno.
Como consecuencia los aldehídos y cetonas poseen un elevado momento dipolar
de hace que existan entre sus moléculas intensas fuerzas de atracción del tipo
dipolo-dipolo, por lo que estos compuestos tienen puntos de fusión y de ebullición
más altos que los de los hidrocarburos de análogo peso molecular. Sin embargo,
las moléculas de aldehídos y cetonas no pueden asociarse mediante enlaces de hidrógeno,
por lo que sus puntos de fusión y de ebullición son más bajos que los de los correspondientes
alcoholes. Concretamente, los puntos de ebullición de los primeros términos de
aldehídos y cetonas son unos 60ºC más altos que los de los hidrocarburos del mismo
peso molecular y también unos 60ºC más bajos que los de los correspondientes alcoholes.
Esta diferencia se hace cada vez menor, como es lógico, al aumentar la cadena
hidrocarbonada y perder influencia relativa el grupo funcional.
En cuanto
a la solubilidad, los primeros miembros de ambas series de aldehídos y cetonas
son completamente solubles en agua. Al aumentar la longitud de la cadena hidrocarbonada
disminuye rápidamente la solubilidad en agua. Así, por ejemplo, los aldehídos
y cetonas de cadena lineal con ocho o más átomos de carbono son prácticamente
insolubles en agua. Sin embargo, los compuestos carbonílicos son muy solubles
en disolventes orgánicos apolares, como éter etílico, benceno, etc. Por otra parte,
la propia acetona es un excelente disolvente orgánico, muy utilizado por su especial
capacidad para disolver tanto compuestos polares (alcoholes, aminas, agua, etc.),
como apolares (hidrocarburos, éteres, grasas, etc.).
Métodos de
obtención
Entre los métodos de obtención de compuestos carbonílicos
unos son comunes a aldehídos y cetonas, mientras que otros son propios de cada
una de estas series, por lo que es conveniente estudiarlos por separado.
1.°
Métodos de obtención comunes a aldehídos y cetonas
a)
Oxidación de alcoholes
La oxidación de alcoholes primarios produce
en una primera etapa, aldehídos; mientras que la oxidación de alcoholes secundarios
conduce a cetonas.
Las cetonas son resistentes a la oxidación posterior,
por lo que pueden aislarse sin necesidad de tomar precauciones especiales. En
cambio, los aldehídos se oxidan fácilmente a los ácidos carboxí1icos correspondientes.
Para evitar esta oxidación es necesario separar el aldehído de la mezcla reaccionante
a medida que se va formando, lo que se consigue por destilación, aprovechando
la mayor volatilidad de los aldehídos inferiores respecto a los correspondientes
alcoholes. Así se obtiene, por ejemplo, el
propanal:
| CH3—CH2—CH2OH | Cr2O7Na2
+ SO4H2

60-70 ºC | CH3—CH2—CHO |
| 1-propanol |
| propanal
|
b) Hidratación de
alquinos
En presencia de sulfato mercúrico y ácido sulfúrico diluido,
como catalizadores, se adiciona una molécula de agua al triple enlace de un alquino,
con lo que se forma primero un enol que, al ser inestable, se isomeriza
por reagrupamiento en un compuesto carbonílico. Únicamente cuando se utiliza acetileno
como producto de partida se obtiene acetaldehído, según la reacción:
HC CH + H2O CH + H2O | SO4H2

SO4Hg | CH2=CHOH |  | CH3—CHO |
| acetileno |
| etenol
|
| etanal
(acetaldehído) |
Este es el procedimiento
industrial más utilizado en la actualidad para la fabricación de acetaldehído,
que es la materia prima de un gran número de importantes industrias orgánicas.
Cuando se utilizan acetilenos alquilsustituidos el producto final es una
cetona.
c) Ozonólisis de alquenos
La ozonólisis
de alquenos da lugar a aldehídos o cetonas, según que el carbono olefínico tenga
uno o dos sustituyentes hidrocarbonados. Esta reacción no suele utilizarse con
fines preparativos, sino más bien en la determinación de estructuras para localizar
la posición de los dobles enlaces.
2.º Métodos
de obtención de aldehídos
a) Reducción de cloruros
de acilo
La reducción directa de ácidos carboxílicos a aldehídos
no es fácil de realizar, porque los ácidos se reducen con gran dificultad. Por
ello, el procedimiento utilizado es convertir primero el ácido en su cloruro (cloruro
de acilo) que se reduce fácilmente a aldehído:
Para impedir la posterior reducción del
aldehído a alcohol se ha ideado el empleo de un
catalizador de
paladio
envenenado (es decir, desactivado) con azufre.
b) Hidrólisis
de dihalogenuros geminales
Mediante la hidrólisis de dihalogenuros
geminales
(los dos átomos de halógeno están en el mismo carbono)
pueden obtenerse aldehídos y cetonas, en general, aunque sólo tiene interés para
la preparación de aldehídos aromáticos, concretamente de benzaldehído, por la
facilidad con que se hidrolizan los dihalogenometilarenos. Así, cuando se clora
fotoquímicamente tolueno,
Ar—CH3, se
forma

,

-diclorotolueno,
ArCHCl2 (cloruro
de bencilideno), que se hidroliza fácilmente para dar benzaldehído.
3.º
Métodos de obtención de cetonas
a)
Reacción de nitrilos con reactivos de Grignard
Los reactivos de
Grignard o magnesianos,
R—MgX,
se adicionan fácilmente a los enlaces múltiples polares, formando compuestos de
adición que se hidrolizan con gran facilidad. Este es el fundamento de la gran
variedad de aplicaciones de los magnesianos en síntesis orgánica. En el caso de
los nitrilos,
R—C N
N, la reacción de adición y posterior
hidrólisis (en medio ácido), puede representarse esquemáticamente mediante la
ecuación:
R—C N + R'—MgX N + R'—MgX |  | (RR')C=N—MgX
| 2H2O

|
R—CO—R' + XMgOH + NH3 |
b) Síntesis de Friedel-Crafts
Se
pueden obtener cetonas a partir de hidrocarburos, empleando
como reactivo atacante un halogenuro de acilo,
R—CO—X
, según la siguiente reacción:
| Ar—H + X—CO—R
| Cl3Al

|
Ar—CO—R + XH |
Si
R es un radical alifático, se obtiene una cetona mixta, mientras
que si es aromático la cetona será también aromática.
Modernamente,
la acetona se obtiene industrialmente en el proceso de obtención de fenol
por oxidación catalítica de isopropilbenceno (cumeno).
Reacciones
de los aldehídos y cetonas
a) Hidrogenación
Los
aldehídos y cetonas se transforman en alcoholes al hacerlos pasar sobre
Cu
a 300 °C en un proceso inverso al de deshidrogenación de alcoholes.
Los
aldehídos conducen a la formación de alcoholes primarios:
| R—CHO
+ H2 | Cu

300 ºC
|
Rr—CH2OH |
| aldehído | | alcohol
primario |
Las cetonas por su
parte se reducen a alcoholes secundarios:
| R—CO—R' + H2
| Cu

300 ºC
|
R—CHOH—R' |
| cetona | | alcohol
secundario |
b) Reacción
bisulfítica
Los aldehídos y metilcetonas (con un grupo metilo
en posición

), reaccionan con bisulfito
sódico para dar lugar a un compuesto cristalino: el «compuesto bisulfítico».
| R—CHO
+ HSO3Na |  | R—CHOH—SO3Na |
| aldehído | | derivado
bisulfítico de un aldehído |
| R—CO—CH3
+ HSO3Na |  | R—COH(CH3)—SO3Na |
| cetona | | derivado
bisulfítico de una cetona |
c)
Adición de CNH
Aldehídos y cetonas adicionan cianuro de hidrógeno
para dar lugar a la formación de
cianhidrinas (hidroxinitrilos).
| R—CHO
+ HCN |  | R—CHOH—CN |
| aldehído | | cianhidrina |
| R—CO—R' + HCN
|  | R—COH(CN)—R' |
| cetona | | cianhidrina |
d) Condensación aldólica
Los
aldehídos en presencia de disoluciones diluidas de hidróxidos alcalinos sufren
la denominada «condensación aldólica», con formación de un aldol (molécula
que contiene simultáneamente las funciones aldehído y alcohol).
e) Polimerización
En
presencia de ácidos inorgánicos diluidos, los aldehídos sufren una autoadición
con ciclación simultánea en la que se forman trímeros cíclicos; así en
el caso del formaldehído se forma trioxano:
En
el caso del acetaldehído se forma paraldehído. Las cetonas, sin embargo,
no se polimerizan.
f) Oxidación
Las cetonas son
muy resistentes a la acción de los agentes oxidantes, y cuando se oxidan lo hacen
dando lugar a una mezcla de ácidos carboxílicos con menos átomos de carbono cada
uno de ellos que la cetona que se oxida.
Los aldehídos se oxidan con facilidad
incluso bajo la acción de oxidantes suaves para dar lugar a un ácido carboxílico
(o sus sales) con el mismo número de átomos de carbono que el aldehído sometido
a oxidación.
| R—CHO
+ 2AgOH + | NH4OH
|  | R—COONH4 +
2 H2O + 2Ag |
|
| aldehído | hidróxido
amónico |
| sal
amoniacal del
ácido carboxílico |
el
reactivo es una disolución amoniacal
de
nitrato de plata. Con
frecuencia la plata se deposita sobre el vidrio del recipiente originando un espejo.
| R—CHO
+ 2Cu(OH)2
+ | NaOH |  | R—COONa +
3 H2O + Cu2O
|
| aldehído | hidróxido
sódico |
| sal
amoniacal del
ácido carboxílico |
los
reactivos son: una disolución de
sulfato cúprico y otra de
hidróxido
sódico y
tartrato sodopotásico (que evita la precipitación del hidróxido
cúprico).