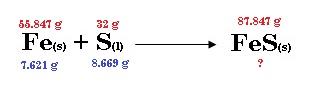miércoles, 28 de abril de 2021
Número atómico, masa atómica ( PRIMERO INTENSIVO) REALIZAR LA TAREA Y ENVIAR A dperalta.tareas.ocp@gmail.com
ECLIPSE TOTAL DE SOL. ENSEÑANZA Y RECURSOS EDUCATIVOS ( OCTAVO) REALIZAR LA TAREA Y ENVIAR A OTRO CORREO QUE ESTA AL FINAL DEL TEXTO
ECLIPSE TOTAL DE SOL. ENSEÑANZA Y RECURSOS EDUCATIVOS

DESCRIPCIÓN DE UN ECLIPSE TOTAL DE SOL

Asignaturas(s):
• Astronomía, Física, Matemáticas, Historia, Estadística, Geografía
Tipo de Recursos:
• Descripción detallada (15 y 30 páginas respectivamente) de los eclipses totales de Sol, las expediciones de GLORIA y de la medición de la inercia térmica atmosférica durante un eclipse.
• Vídeos cortos (~3 minutos) en YouTube sobre los eclipses totales de Sol.
Webs: Documento de la actividad (Documento PDF de Referencia).
Publicidad del eclipse total de Sol del 2012
Publicidad del eclipse total de Sol del 2013
Idioma(s):
• Inglés, Italiano, Español, Polaco, Checo, Ruso
Nivel(es) Educativo(s):
• Educación Secundaria (12-15 años), Educación Secundaria/Bachillerato (15-18 años).
Descripción:
Un eclipse total de Sol ocurre cuando la Luna pasa entre el Sol y la Tierra, y bloquea totalmente al Sol desde nuestro punto de vista. Esto sólo puede ocurrir en Luna Nueva y si el Sol y la Luna están perfectamente alineados, visto desde la Tierra. Los eclipses solares totales son uno de los eventos astronómicos más increíbles de la naturaleza. Estos documentos y vídeos ofrecen descripciones detalladas de cómo se producen los eclipses, cómo se ven, y lo que se puede aprender sobre el Sol y la atmósfera local durante un eclipse.
MEDIDA DE LA INERCIA TÉRMICA ATMOSFÉRICA DURANTE UN ECLIPSE TOTAL DE SOL

Asignaturas(s):
• Astronomía, Física Atmosférica, Matemáticas, Estadística
Tipo de Recurso:
• Herramienta de Análisis: Medición online de la inercia térmica de la atmósfera.
Web: Herramienta web Meteo
Idioma(s):
• Inglés, Italiano, Español, Polaco, Checo, Ruso, Francés, Alemán
Nivel(es) Educativo(s):
• Educación Secundaria (12-15 años), Educación Secundaria/Bachillerato (15-18 años).
Descripción:
Durante los eclipses totales de Sol de 2012 y 2013, los astrónomos de GLORIA grabaron unas películas e imágenes espectaculares (ver álbum de fotos del 2012 y 2013). También utilizaron una estación meteorológica para registrar datos ambientales, en especial la temperatura y la intensidad de la luz. Un efecto interesante que se produce durante el curso de un eclipse, es la disminución de la temperatura del medio ambiente debido a la disminución de la radiación solar o la luminosidad del entorno. Lo interesante es que el fenómeno no se produce instantáneamente cuando el Sol está completamente cubierto, sino que se produce en un momento posterior, debido al hecho de que la atmósfera tiene masa. El tiempo de retardo puede variar desde 2 hasta 20 minutos, dependiendo de muchos factores, como el momento del día en que se produce el eclipse, la presencia de cuerpos de agua cercanos, como un lago o el océano, la proximidad a las zonas boscosas, etc.
Utilizando esta herramienta interactiva, se puede medir la inercia térmica de la expedición del 2012 por sí mismo y comparar su resultado con los valores obtenidos por otros.
TAREA
REALIZAR LAS ACTIVIDADES DEL LIBRO DE LAS PAGINAS 21, 22 Y ENVIAR A dperalta.tareas.ocp@gmail.com el otro correo no sirve. Saludos
Reactivo limitante y reactivo en exceso ( Segundo intensivo) Realice la tarea y enviar a un nuevo correo
Reactivo limitante y reactivo en exceso
ACTIVIDAD DE REFLEXIÓN INICIAL:
Imaginemos que queremos hacer emparedados o sándwiches. Para un emparedado necesitamos 2 rebanadas de pan y 1 de jamón. Pensemos ahora que tenemos 20 rebanadas de pan y solamente 5 rebanadas de jamón.
a) ¿Cuántos emparedados podremos hacer?
|
b) ¿Por qué? Trata de hacer un análisis profundo y contesta argumentando.
|
c) ¿Cuál es el ingrediente que se termina primero?
|
d) ¿Cuál el ingrediente que tenemos en exceso?
|
A partir de la situación anterior, vamos a analizar dos conceptos muy importantes para el trabajo de un químico en situaciones reales que implican reacciones químicas.
a) El reactivo limitante es aquel del cual tenemos en menor cantidad y, por lo tanto, se terminará primero al momento de la reacción química, dando como resultado el final de la reacción, esto quiere decir que cuando se termine ya no se podrá seguir generando cierto producto. En el caso anterior, el reactivo limitante es el jamón, ya que al terminarse no se pueden seguir haciendo más emparedados
b) El reactivo en exceso es aquel del cual tenemos más de lo necesario para que se lleve a cabo la reacción química. En el caso de los emparedados, el reactivo en exceso son las rebanadas de pan, ya que sólo se utilizaron 10 rebanadas para los únicos 5 emparedados que se pudieron hacer.
Debido a la presencia del reactivo limitante, podemos decir que las reacciones van a estar “limitadas” por éste, por lo cual cuando vayamos a obtener la cantidad de cierto producto tenemos que partir del reactivo limitante para poder sacar la cantidad de producto correcta.
EJEMPLOS
1.- A altas temperaturas el azufre se combina con el hierro para formar el sulfato de hierro (II) café oscuro:
En un experimento 7.621 g de Fe se dejan reaccionar con 8.669 g de S.
a) ¿Cuál de los dos es el reactivo limitante?
Antes de cualquier otra cosa, es conveniente sacar las masas teóricas de los reactivos y del producto. Después de eso, procedemos a anotar las masas reales dadas.
Para proceder a conocer cuál es el reactivo limitante, vamos a evaluar los dos reactivos y ver cuál de los dos producen menos FeS, el cual será el reactivo limitante.
b) Calcula la masa de FeS formada.
La ventaja de utilizar el método anterior, es que ya nos da la masa directamente del FeS.
Respuesta: 11.988 g= 12 g de FeS.
c) ¿Qué cantidad del reactivo excedente (en g) queda al final de la reacción?
Sabemos por el procedimiento anterior que el reactivo en exceso es el azufre. Por lo cual, necesitamos evaluar la cantidad de azufre que necesita para reaccionar nuestra cantidad de hierro inicial:
TAREA
1. Conteste las preguntas de la parte de arriba
2 Resuelve el siguiente problema.
3 Por favor enviar al correo dperalta.tareas.ocp@gmail.com el otro correo no sirve.
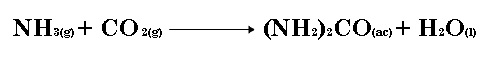
La UREA [(NH2)2CO] se usa como fertilizante, como alimento para animales y en la industria de los polímeros. Se prepara por reacción del amoniaco con el dióxido de carbono:
En cierto proceso, se hacen reaccionar 637.3 g de NH3 con 1141 g de CO2. a) ¿Cuál de los dos reactivos es el limitante? |
lunes, 26 de abril de 2021
Restaurar nuestra Tierra ( Todos los cursos ) Realizar la tarea propuesta
Restaurar nuestra Tierra
La Madre Tierra claramente nos pide que actuemos. Los océanos se llenan de plásticos y se vuelven más ácidos. El calor extremo, los incendios forestales y las inundaciones, así como una temporada de huracanes en el Atlántico que ha batido récords, han afectado a millones de personas. Ahora nos enfrentamos al COVID -19, una pandemia sanitaria mundial con una fuerte relación con la salud de nuestro ecosistema.
El cambio climático, los cambios provocados por el hombre en la naturaleza, así como los crímenes que perturban la biodiversidad, como la deforestación, el cambio de uso del suelo, la producción agrícola y ganadera intensiva o el creciente comercio ilegal de vida silvestre, pueden aumentar el contacto y la transmisión de enfermedades infecciosas de animales a humanos (enfermedades zoonóticas).
De acuerdo con el PNUMA (Programa de las Naciones Unidas para el Medio Ambiente), una nueva enfermedad infecciosa emerge en los humanos cada 4 meses. De estas enfermedades, el 75% provienen de animales. Esto muestra las estrechas relaciones entre la salud humana, animal y ambiental.
Los ecosistemas sustentan todas las formas de vida de la Tierra. De la salud de nuestros ecosistemas depende directamente la salud de nuestro planeta y sus habitantes. Restaurar nuestros ecosistemas dañados ayudará a acabar con la pobreza, a combatir el cambio climático y prevenir una extinción masiva. El Decenio de las Naciones Unidas para la Restauración de los Ecosistemas, que se lanzará oficialmente el Día Mundial del Medio Ambiente (5 de junio), nos ayudará a prevenir, detener e invertir la degradación de los ecosistemas en todos los continentes y en todos los océanos. Pero sólo lo conseguiremos si todo el mundo pone de su parte.
Recordemos hoy más que nunca en este Día Internacional de la Madre Tierra que necesitamos un cambio hacia una economía más sostenible que funcione tanto para las personas como para el planeta. Promovamos la armonía con la naturaleza y la Tierra. ¡Únete al movimiento mundial para restaurar la madre Tierra!

¿Estamos realmente cuidando el planeta Tierra?
Conoce las cifras que muestran el progreso en nuestra acción climática. No perdamos la oportunidad de limitar el aumento de la temperatura terrestre.
La importancia de la biodiversidad para los humanos
El brote de coronavirus representa un riesgo enorme para la salud pública y la economía mundial, pero también para la diversidad biológica. Sin embargo, la biodiversidad puede ser parte de la solución, ya que una diversidad de especies dificulta la propagación rápida de los patógenos.
Igualmente, cada vez es más evidente su impacto en la salud humana. Los cambios en la biodiversidad afectan al funcionamiento de los ecosistemas y pueden ocasionar alteraciones importantes de los bienes y servicios que estos proporcionan. Los vínculos específicos entre la salud y la biodiversidad incluyen posibles impactos en la nutrición, la investigación sanitaria y la medicina tradicional, la generación de nuevas enfermedades infecciosas y cambios significativos en la distribución de plantas, patógenos, animales e incluso asentamientos humanos, algo que puede ser alentado debido al cambio climático.
A pesar de los esfuerzos actuales, la biodiversidad se está deteriorando en todo el mundo a un ritmo sin precedentes en la historia humana. Se estima que alrededor de un millón de especies animales y vegetales se encuentran actualmente en peligro de extinción.
Con este panorama general y el escenario del coronavirus, nuestra prioridad inmediata es evitar la propagación de COVID-19, pero a largo plazo, es importante abordar la pérdida de hábitat y biodiversidad.
Estamos en esta lucha juntos con nuestra Madre Tierra.
TAREA
Realice un collage sobre la importancia de el día de la tierra
viernes, 23 de abril de 2021
Cometa y un asteroide ( OCTAVO INTENSIVO) REALICE LA TAREA PROPUESTA
¿Qué diferencia hay entre un cometa y un asteroide?
Ambos cuerpos tienen características comunes o similares. Por eso, establecer una distinción entre cometas y asteroides resulta, a veces, complicado. A continuación veremos algunas de las diferencias más importantes.
Composición
Esta es una de las mayores diferencias entre cometas y asteroides. Los cometas son cuerpos formados principalmente de hielo, polvo, roca y compuestos orgánicos. Por eso, cuando se aproximan hacia el Sol se derriten con facilidad.
Por su parte, los asteroides están compuestos de metales y roca. Estos elementos son más pesados y estables, y no les afecta tanto el calor del Sol.

Origen
Según algunas teorías, los asteroides se formaron más cerca del Sol. A esta distancia, la temperatura impidió que existiera hielo en su composición.
Por el contrario, se creé que los cometas se formaron a mayores distancias, en los límites del Sistema Solar, donde el hielo pudo permanecer intacto.
Sin embargo, algunos estudios afirman que los cometas se formaron en el interior del Sistema Solar y posteriormente fueron expulsados hacia el Cinturón de Kuiper y la Nube de Oort debido a los efectos gravitacionales de los gigantes gaseosos. Estos mismos tirones gravitacionales desvían continuamente a cometas y asteroides, enviándolos hacia el interior del Sistema Solar.
Órbitas
La mayoría de los asteroides se encuentran en el denominado cinturón de asteroides, situado entre las órbitas de Marte y Júpiter. Este cinturón contiene millones de asteroides, algunos miden centímetros y otros cientos de kilómetros. Así, las órbitas de los asteroides suelen ser más cortas y circulares.
Los cometas tienen órbitas mucho más extensas y alargadas, por lo que solo se acercan al Sol cada muchos años. Esto es debido a que los cometas tienen su origen en el Cinturón de Kuiper y la Nube de Oort. Por su parte, solo se han identificado alrededor de 4.000 cometas. Puede que en el pasado hubiera millones pero al acercarse al Sol se vaporizan hasta desintegrarse y desaparecer.
Coma y cola
Los cometas se caracterizan por sus extensas colas, normalmente de colores verdosos. La cola del cometa se produce cuando el viento solar azota la nube de gas que rodea el cometa (también llamada coma o atmósfera). Al acercarse al Sol, su cola va aumentando y nos deja imágenes espectaculares.
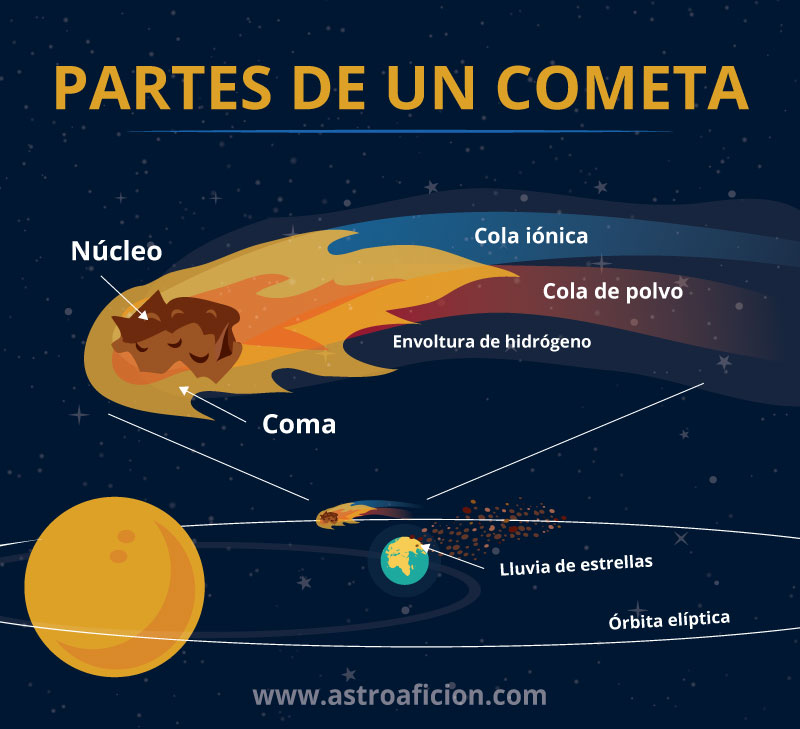
Por contra, los asteroides no tienen colas. Debido a su composición, se mantienen sólidos incluso en las cercanías del Sol. Sin embargo, en 2013 se descubrió por primera vez un asteroide con una cola bastante larga. Estos asteroides, conocidos como asteroides activos, son extremadamente raros y solo se conocen trece. Se piensa que la cola de los asteroides aparece cuando son golpeados por otros asteroides, generando una nube de gas y polvo a su alrededor.
Diferencias poco claras
Aunque las diferencias suelen ser suficientes para diferenciar un cometa de un asteroide, en ocasiones se crean dudas al respecto.
La existencia de asteroides con cola es una de las principales controversias sobre esta clasificación. Un ejemplo claro es por ejemplo el asteroide Faetón, que es el causante de la lluvia de estrellas de las Gemínidas. Este asteroide es el único al que se asocia una lluvia de estrellas, lo que ha llevado a pensar en ocasiones que se trata de un cometa extinto, el cual ha perdido ya toda su coma en sus numerosas aproximaciones al Sol.
Además, algunos asteroides pueden tener una capa de hielo en su superficie, lo que podría formar una cola al derretirse. Aún así, la ciencia todavía los concibe como objetos distintos y diferenciados. Por lo que es importante que conozcamos sus características y diferencias.
TAREA
Átomo ( PRIMERO INTENSIVO) REALICE LA TAREA PROPUESTA
Átomo
El átomo es la partícula más pequeña y estable que mantiene todas las propiedades de un elemento. Es decir, la parte de materia más pequeña que puede ser medida.
Cada átomo, a su vez, posee partes más pequeñas, conocidas como partículas subatómicas. Estas incluyen protones, neutrones y electrones.
Los átomos se combinan para formar moléculas que luego interactúan para formar sólidos, líquidos y gases.
Estructura del átomo
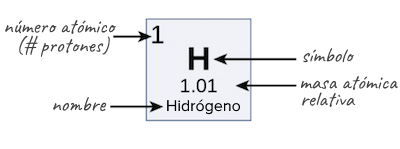
El átomo está compuesto por dos regiones diferentes: el núcleo, donde están los protones y los neutrones, y la nube u orbitales electrónicos, donde se encuentran los electrones.
Núcleo
El núcleo es el centro o corazón del átomo que está compuesto por protones y neutrones. Tanto protones como neutrones poseen masa, pero sólo los protones tienen carga positiva.
Todos los átomos de un elemento tienen el mismo número de protones, pero el número de neutrones puede cambiar. A estos átomos con diferente número de neutrones se les conoce como isótopos de un elemento.
Por ejemplo, el carbono-12 y el carbono-14 son isótopos del elemento carbono, que tiene 6 protones en su núcleo, pero el carbono-12 tiene 6 neutrones, mientras que el Carbono-14 tiene 8 neutrones.
Nube electrónica
Rodeando el núcleo, se encuentran los electrones en una especie de nube. Los electrones poseen carga negativa.
Los átomos se transforman en iones cuando ganan o pierden electrones.
Si hiciéramos la comparación de la estructura del átomo con un campo de fútbol, la nube electrónica ocuparía todo el campo de fútbol, mientras que el núcleo del átomo sería un granito de arena en el medio del campo
Partes del átomo

El átomo está compuesto por tres partículas subatómicas: protones, neutrones y electrones.
Protón
Es la partícula cargada positivamente que se encuentra en el núcleo del átomo. Tiene una masa de aproximadamente 1,67 x 10-24 gramos, que es igual a 1 Dalton.
El número de protones de un átomo determina el número atómico del elemento. Por ejemplo, el hidrógeno posee un solo protón, entonces su número atómico es igual a 1.
Neutrón
Es la partícula neutra del núcleo del átomo con masa igual a la de un protón, es decir, un Dalton.
Electrón
Los electrones son las partículas subatómicas que orbitan alrededor del núcleo. El electrón tiene una masa de 9,11 x 10-28 gramos, esto es 1/1800 la masa del protón. Su masa es tan pequeña que se considera despreciable.
Cada electrón posee una carga negativa. La carga de un átomo es normalmente neutra, pues tiene tantos protones como electrones, haciendo que las cargas positivas de uno se cancelen con las cargas negativas del otro.
TAREA
REALICE UN MAPA CONCEPTUAL DE ESTE TEMA. RECUERDE QUE PUEDE TAMBIEN UTILIZAR EL LIBRO DEL MINISTERIO DE EDUCACIÓN
REACCIONES QUÍMICAS ( SEGUNDO BGU INTENSIVO) REALICE LA TAREA PROPUESTA
IGUALE CINCO ECUACIONES QUIMICAS Y PONGA EL NUMERO DE MOLES Y CALCULE SU MASA, COMPRUEBE SI ESTA BIEN IGAULADA
1 Ajusta las siguientes ecuaciones químicas
- a) C3H8 + O2 → CO2 + H2O
- b) Na + H2O → NaOH + H2
- c) KOH + H2SO4→ K2SO4 + H2O
- d) Cu(NO3)2→ CuO + NO2 + O2
3 Ajusta las siguientes ecuaciones químicas:
- a) NO (g) + O2 (g) → NO2 (g)
- b) N2O5 (g) → NO2 (g) + O2 (g)
- c) C6H12 (l) + O2 (g) → CO2 (g) + H2O (g)
- d) Al2O3 (s) + HCl (ac) → AlCl3 (ac) + H2O (l)
- e) NO2 (g) + H2O (l) → HNO3 (ac) + NO (g)
IGUALACIÓN ( PRIMERO BGU REGULAR) REALICE LA TAREA PROPUESTA
IGUAKLE POR CUALQUIER MÉTODO, las siguientes ecuaciones químicas:
1.- Mn2O7 → MnO2 + O2
2.- Sb + HCl → SbCl3 + H2
3.- PbS + O2 → PbO + SO2
4.- CaCO3 → CaO + CO2
5.- Fe(OH)3 + H2SO4 → Fe2 (SO4)3 + H2O