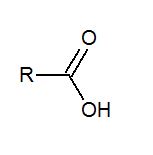
Oxisales neutras
Definición de oxisales neutras
Son compuestos ternarios (no metal, oxígeno y metal) que resultan de la sustitución de TODOS los hidrógenos de un oxoácido por un metal (o un catión no metálico). Pueden considerarse también como compuestos binarios formados por un catíon y un anión (precedente del ácido al perder sus hidrógenos). Se obtienen por neutralización total de un hidróxido o base con un oxoácido:
Ácido oxoácido + hidróxido → sal neutra + agua
o atacando un metal con ácido: Oxoácido + metal → sal neutra + hidrógeno
Formulación de las oxisales neutras
El procedimiento de formulación de las oxisales neutras depende del sistema de nomenclatura en que se nos presenten, así que primero explicaremos el sistema de nomenclatura y a continuación cómo se formularía la sal:
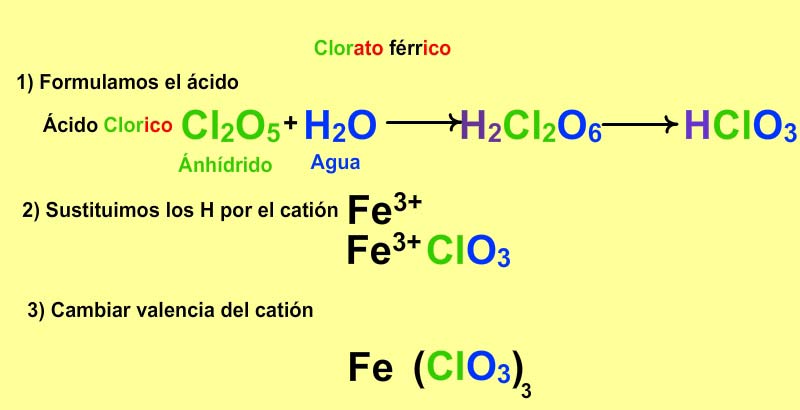
1) Nomenclatura tradicional de las oxisales neutras
Nombramos el anión como se indicó en los ácidos pero cambiando las terminaciones - oso por - ito e - ico por - ato y a continuación el metal con los sufijos correspondientes según el estado de oxidación. Ejemplo: AuClO4, perclorato auroso, ya que el cloro tiene el estado de oxidación +7 y el oro +1.
Para formular la sal a partir de la nomenclatura tradicional formulamos primero el ácido correspondiente y después sustituimos todos los hidrógenos por el catión y ponemos al anión la valencia del catión como subíndice (si es posible, simplificamos).
2) Nomenclatura sistemática funcional (Stock)de las oxisales neutras
La única diferencia de esta nomenclatura con la tradicional es que el estado de oxidación del catión se indica con números romanos entre paréntesis en lugar de mediante sufijos. Ejemplo: Ni2(SO4)3, Sulfato de niquel (III)
El método o sistema de formulación en esta nomencaltura de Stock, no difiere del anterior. Ejemplo: Carbonato de cobalto (III).
1) Formulamos el ácido carbonico → H2CO3.
2) Sustituimos los dos hidrogenos del ácido por el catión Co3+ → Co23+CO3.
3) Ponemos la valencia del catión al anión como subíndice y entre paréntesis → Co2(CO3)3.
3) Nomenclatura sistemática (anterior al libro rojo de la IUPAC del 2005) de las oxisales neutras
Primero se nombran el anión con Oxo precedidos de los prefijos griegos multiplicativos que indican el número de oxígenos presentes en la molécula unido al nombre del no metal terminado en el sufijo -ato (y con sus prefijos multiplicativos si hubiese más de un átomo central) , seguidos del número de oxidación del átomo de no metal central entre paréntesis y en números romanos, después el catión con los prefijos multiplicativos que sean necesarios. Si el anión tuviese subíndice (entre paréntesis) se puede expresar mediante los prefijos numerales multiplicativos griegos bis-, tris-, tetraquis-, pentaquis-, etc. o indicando el número de oxidación del catión en romanos y entre paréntesis al modo de Stock. Ejemplo: Fe2(SO3)3, tris[trioxosulfato (IV)] de hierro ó bien trioxosulfato (IV) de hierro(III)
El método para formular esta nomenclatura es el más sencillo pues únicamente hay que introducir los subíndices que se nos indican mediante los prefijos (o valencia del catión) como puede constatarse en el ejemplo anterior.
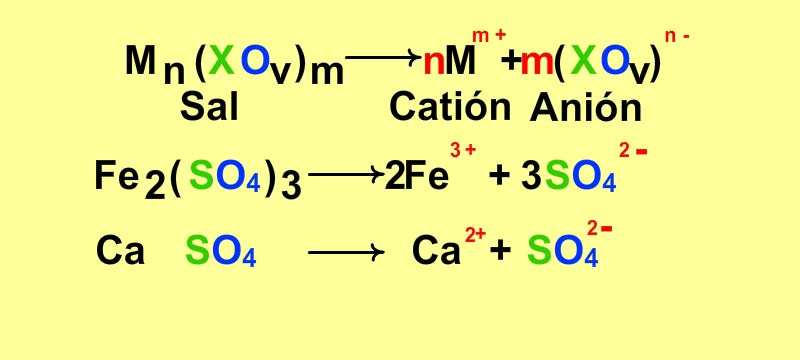
Disociación de oxisales en sus correspondientes aniones y cationes
Las oxisales se descomponen o disocian en disolución acuosa en sus cationes y aniones constituyentes según:
Mn(XOv)m → nMm+ + m(XOv)n-
Recomendaciones de la IUPAC para nombrar las oxisales neutras (libro rojo del 2005)
La IUPAC en su libro rojo del 2005 recomienda para las sales dos nomenclaturas:
1) La de adición según la cual la sal se considera un compuesto binario escribiendose el nombre del anión seguido del nombre del catión, con la carga entre paréntesis (sistema de Ewens-Bassett) Si el catión tiene un único número de oxidación no se especifica. En esencia es como la sistemática pero poniendo las cargas del anión (en lugar del número de oxidación del no metal) y el catión pero poniendo las cargas en números arábigos y con su signo y en vez de oxo para el oxígeno se pone oxido. Ejemplo: Fe2(SO3)3 → trioxido sulfato(2-) de hierro(3+).
2) Estequiométrica que es como la sistematica, cambiando oxo por oxido y sin indicar estados de oxidación. Ejemplo: Fe2(SO3)3 →tris(trioxidosulfato) de dihierro.
Ejemplos de oxisales neutras | |||||
Compuesto | Sistemática | Stock | Tradicional | De adición (2005) | Estequiométrica (2005) |
Fe2(CO3)3 | tris[trioxocarbonato (IV)] de dihierro | carbonato de hierro (III) | carbonato férrico | trioxidocarbonato (2-) de hierro (3+) | tris[trioxidocarbonato] de dihierro |
Pb3(PO4)4 | tetraoxofosfato (V) de plomo (IV) | fosfato de plomo (IV) | fosfato plúmbico | tetraoxidofosfato (3-) de plomo (4+) | tetraquis[tetraoxidofosfato] de triplomo |
AuNO2 | dioxonitrato (III) de oro (I) | nitrito de oro (I) | nitrito auroso | dioxidonitrato (1-) de oro (1+) | dioxidonitrato de oro |
Cu(BrO3)2 | trioxobromato (V) de cobre (II) | bromato de cobre (II) | bromato cúprico | trioxidobromato (1-) de cobre (2+) | bis[trioxidobromato] de cobre |
MgTeO4 | tetraoxotelurato (VI) de magnesio | telurato de magnesio | telurato de magnesio | tetraoxidotelurato (2 -) de magnesio | tetraoxidotelurato de magnesio |
Na2S2O7 | heptaoxodisulfato (VI) de sodio | disulfato de sodio | disulfato de sodio | µ-oxido-bis(hidroxidodioxidosulfato) (2-) de sodio | heptaoxidodisulfato de disodio |
Ni2Si2O7 | heptaoxodisilicato (IV) de diniquel | disilicato de niquel (III) | disilicato niquélico | μ-oxidobis(trioxidosilicato)(2-) de niquel (3+) | heptaoxidodisilicato de diniquel |
Si se nos da la fórmula de la oxisal neutra
Descomponemos o disociamos la sal en su anión y su catión. A partir de la carga del anión y el estado de oxidación del oxigeno hallamos el estado de oxidación del elemento central. Con esta información y el estado de oxidación del catión podemos escribir el nombre de la sal en las cinco nomenclaturas, si es una sal que procede de ácido simple como mostramos en la animación siguiente. Si la sal procede de poliácidos, peroxoáciodos ácidos polidratados y demás ácidos especiales, para la nomenclatura de adición o estructural hay que conocer la estructura de la molécula.

TAREA
EN SU CUADERNO ESCRIBA LA FOMACIÓN Y N OMENCLATURA DE ESTAS SALES NEUTRAS
ESCRIBA CINCO SALES OXISALES NEUTRAS CON SU REACCIÓN Y NOMBRE