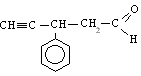
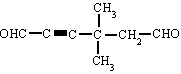
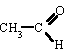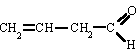SALES NEUTRAS (OXISALES) | |||
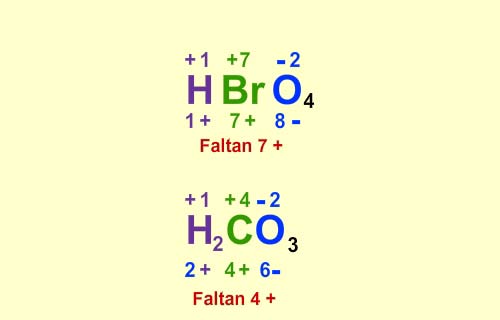
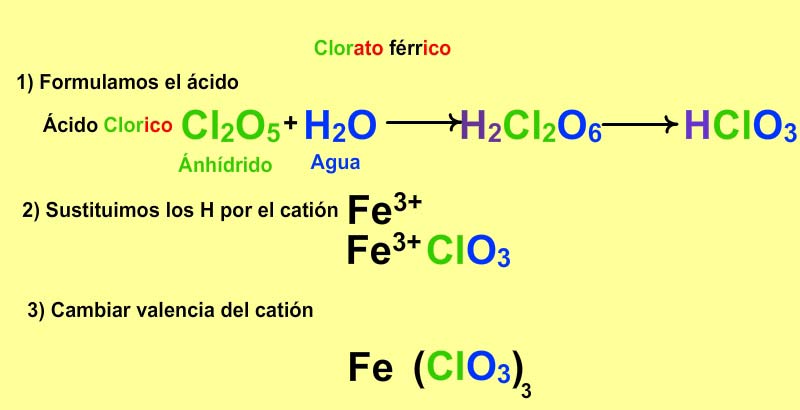
| Son compuestos ternarios constituidos por un no metal, oxígeno y metal. Se obtienen por neutralización total de un hidróxido sobre un ácido oxoácido. La reacción que tiene lugar es: ÁCIDO OXOÁCIDO + HIDRÓXIDO --> SAL NEUTRA + AGUA La neutralización completa del ácido por la base lleva consigo la sustitución de todos los iones hidrógeno del ácido por el catión del hidróxido, formándose además agua en la reacción. Puede, pues, considerarse como compuestos binarios formados por un catión (proveniente de la base) y un anión (que proviene del ácido). | |||
| SAL | CATIÓN | ANIÓN | SISTEMÁTICA/TRADICIONAL |
| NaClO | Na+ | ClO1- | oxoclorato (I) de sodio |
| hipoclorito sódico | |||
| NaClO2 | Na+ | ClO21- | dioxoclorato (III) de sodio |
| clorito sódico | |||
| NaClO3 | Na+ | ClO31- | trioxoclorato (V) de sodio |
| clorato sódico | |||
| NaClO4 | Na+ | ClO41- | tetraoxoclorato (VII) de sodio |
| perclorato sódico | |||
| K2SO3 | K+ | SO32- | trioxosulfato (IV) de potasio |
| sulfito potásico | |||
| K2SO4 | K+ | SO42- | tetraoxosulfato (VI) de potasio |
| sulfato potásico | |||
| KNO2 | K+ | NO21- | dioxonitrato (III) de potasio |
| nitrito potásico | |||
| KNO3 | K+ | NO31- | trioxonitrato (V) de potasio |
| nitrato potásico | |||
| CaSO4 | Ca2+ | SO42- | tetraoxosulfato (VI) de calcio |
| sulfato cálcico | |||
| Li2CO3 | Li+ | CO32- | trioxocarbonato (IV) de litio |
| carbonato de litio | |||
| KClO2 | K+ | ClO21- | dioxoclorato (III) de potasio |
| clorito potásico | |||
| Fe(BrO3)3 | Fe3+ | BrO31- | tris[trioxobromato (V)] de hierro (III) |
| bromato férrico | |||
| Cu3(PO4)2 | Cu2+ | PO41- | bis[tetraoxofosfato (VI)] de cobre (II) |
| (orto)fosfato cúprico | |||
| Al2(SO4)3 | Al3+ | SO42- | tris[tetraoxosulfato (VI)] de aluminio |
| sulfato de aluminio | |||
| Fe2(CO3)3 | Fe3+ | CO32- | tris[trioxocarbonato (IV)] de hierro (III) |
| carbonato férrico | |||
| SnSiO3 | Sn2+ | SiO32- | trioxosilicato (IV) de estaño |
| silicato de estaño | |||
| (NH4)2SO4 | NH41+ | SO42- | tetraoxosulfato (VI) de amonio |
| sulfato amónico | |||
| KCN | K+ | CN- | cianuro de potasio |
| K2Cr2O7 | K+ | Cr2O72- | heptaoxodicromato (VI) de potasio |
| dicromato potásico | |||