lunes, 12 de junio de 2017
Equilibrio químico ( 2 de BGU) Realizar dos ejemplos parecidos cambiando de datos
EQUILIBRIO QUIMICO
1.- En un recipiente inicialmente vacío, se introducen dos gases A y B a la presión parcial de 1 atm. y 100 ºC. Manteniendo la temperatura y la presión constantes, se produce la siguiente reacción:
A(g) + 2 B(g) <--> 2 C(g) + D(s)
Cuando se alcanza el equilibrio el grado de disociación es de 0.25. Calcular las constantes Kc y Kp así como las presiones parciales de A, B y C.
Por ser las presiones parciales iniciales de A y B iguales, quiere decir que el número de moles de A y B son los mismos, y que llamaremos n
A(g) + 2B(g) <--> 2C(g) + D(s)
n(ini) n n
n(equi) n - 0.25n n - 0.50n 0.50n
n(totales) = 1.75n con los que podemos calcular las fracciones molares de los tres gases en el equilibrio, y como P = 2 atm. también las presiones parciales
X(A) = 0.75n = 0.43 X(B) = X(C) = 0.50n = 0.285
1.75n 1.75n
P(A) = 2·0.43 = 0.86 atm. P(B) = P(C) = 2·0.285 = 0.57 atm.
Aplicando la L.A.M. calculamos la constante de equilibrio:
Kp = P(C)2 = (0.57)2 = 1.2
P(A)·P(B) (0.86)·(0.57)2
Y por último:
Kc = Kp ·(RT)-Dn = 1.2·(0.082·373) = 36.7 , en donde Dn = -1
2.- Se ha encontrado que cuando la reacción:
3 NO2 + H2O <--> 2 HNO3 + NO
llega al equilibrio a 300ºC contiene 0.60 moles de dióxido de nitrógeno, 0.40 moles de agua, 0.60 moles de ácido nítrico y 0.80 moles de óxido nítrico. Calcular cuántos moles de ácido nítrico deben añadirse al sistema para que la cantidad final de dióxido de nitrógeno sea de 0.90 moles. El volumen del recipiente es de 1.00L.
Con los moles existentes en el equilibrio podemos calcular la constante del mismo
3 NO2 + H2O <--> 2HNO3 + NO
Eq(1) 0.60 0.40 0.60 0.80
Kc = (0.60)2 ·(0.80) = 3.3
(0.60)3 ·(0.40)
Al añadir una cantidad de HNO3 , que llamamos A, la reacción se desplaza hacia la izquierda hasta alcanzar un nuevo estado de equilibrio, en el cual tendremos:
3 NO2 + H2O <--> 2HNO3 + NO
Eq(2) 0.60 + 3x 0.40 + x 0.60 + A - 2x 0.80 -x
sabiendo que 0.60m + 3x = 0.90 con lo que x = 0.10 moles
Aplicando de nuevo la L.A.M. la única incógnita será A
3.3 = (0.40 + A)2·(0.70) A = 0.91 moles de HNO3 se añadieron
(0.90)3 · (0.50)
3.- La formación del trióxido de azufre por oxidación del dióxido es un paso intermedio en la fabricación del ácido sulfúrico. La constante de equilibrio (Kp) de la reacción:
2 SO2(g) + O2(g) <--> 2 SO3(g)
es 0.13 a 830ºC. En un experimento se hacen reaccionar 2.00 moles de dióxido de azufre con 2.00 moles de oxígeno. ¿Cúal debe ser la presión total de equilibrio para tener un rendimiento del 70% en trióxido de azufre?
Escribimos de nuevo la reacción con los moles en el equilibrio
2 SO2(g) + O2(g) <--> 2 SO3(g)
n(inic.) 2.00 2.00
n(equi.) 2.00 - 2x 2.00 -x 2x
n(totales) = 4.00 - x
Por ser el redimiento del 70% entonces 2x = 1.4 luego x = 0.7 moles
Calculamos las fracciones molares de cada gas en el equilibrio:
X(SO2) = 0.6/3.3 = 0.18 X(O2) = 1.3/3.3 = 0.40 X(SO3) = 0.42
Y aplicamos la expresión de la constante para calcular la presión total en el equilibrio:
0.13 = (0.42)2 · 1 de donde P = 105 atm.
(0.18)2 ·(0.40) P
4.- A 300ºC y una presión total de 629 atm. la reacción entre el cloruro de hidrógeno y el oxígeno para dar cloro y agua, alcanza el equilibrio cuando se ha completado en un 80%. ¿Cuál tendría que ser la presión para que la reacción alcanzara el equilibrio cuando se hubiese completado en un 50%?
La reacción que tiene lugar es la siguiente:
4 HCl(g) + O2(g) <--> 2 Cl2(g) + 2 H2O(g)
n(inic.) 4n n
n(equi.) 4n - 4na n - na 2na 2na
n(totales) = n(5 - a) sustituyendo a por 0.80 tenemos que
X(HCl) = 0.80/4.20 = 0.19 X(O2) = 0.20/4.20 = 0.048 X(Cl2) = X(H2O) = 1.60/4.20 = 0.38
y como la presión total es 629 atm., podemos calcular la Kp
Kp = 1 · (0.38)2· (0.38)2 = 0.53
629 (0.19)4 · (0.048)
Calculamos de nuevo las fracciones molares para a = 0.50
X(HCl) = 2.0/4.50 = 0.44 X(O2) = 0.50/4.50 = 0.11 X(Cl2) = X(H2O) = 1.0/4.50 = 0.22
Conocida la constante, despejamos P de la expresión
Kp = 1 · (0.22)2· (0.22)2 = 0.53 P = 1.1 atm
P (0.44)4 · (0.11)
4.- Un recipiente de 1.00L se llena con una mezcla en volumenes iguales de oxígeno y dióxido de nitrógeno a 27ºC y 673 mm Hg de presión parcial. Se calienta a 420ºC y una vez alcanzado el equilibrio se encuentran 0.0404 moles de oxígeno. Calcular la constante de equilibrio para el proceso
2NO(g) + O2(g) <--> 2 NO2(g)
y la presión total de la mezcla.
Calculamos primero los moles iniciales de oxígeno, que son los mismos que de dióxido de nitrógeno, por la ecuación:
(673/760)·1,00 = n·0,0820·300 de donde n = 0,0360 moles
Escribimos el equilibrio de la reacción:
2NO(g) + O2(g) <--> 2 NO2(g)
n(ini.) 0.0360 0.0360
n(equi.) 2x 0.0360 + x 0.0360 - 2x
Sabiendo que 0.0360 + x = 0.0404 entonces x = 4.4·10-3
n(totales) = 0.036 + 0.036 + 4.4·10-3 = 0.0764 moles para los cuales le corresponde una presión total de:
P·1.0 = 0.0764·0.082·693 = 4.3 atm.
Para calcular la constante de equilibrio aplicamos la L.A.M. con las presiones parciales correspondientes de cada gas:
Kp = P(NO2)2 = 4.32 ·(0,272/0,0764)2 = 4,1
P(NO)2·P(O2) 4.32 ·(8.8·10-3/0.0764)2·4.4·(0.0404/0.0764)
5.- La constante Kp para la reacción entre el dióxido de carbono puro y el grafito, en exceso, caliente es 10. Calcular: a) ¿Cuál es la composición en volumen de los gases en equilibrio a 817ºC y una presión total de 6,1 atm? ¿cuál es la presión parcial del dióxido de carbono? y b) ¿Para qué presión se obtendrá un 10% en volumen de dióxido de carbono?
CO2(g) + C(s) <--> 2 CO(g)
a) Escribimos los moles en el equilibrio
CO2(g) + C(s) <--> 2 CO(g)
n(1 - a) 2na
n(totales) = n(1 + a)
Calculamos a en el equilibrio mediante la expresión de la constante
Kp = P(CO)2 = 6.12 ·(2na/n(1+a))2 ; de donde a = 0.54
P(CO2) 6.1·(n(1- a)/n(1 + a))
Con lo que X(CO) = 2 · 0.54 = 0.70
1.54
la composición en el equilibrio es 70% en volumen de CO y 30% de CO2
y la presión parcial del CO2 es: P(CO2) = 6.1·0.46 = 1.82 atm.
1.54
b) Si hay un 10% en volumen de dióxido de carbono quiere decir que X(CO2) = 0.10 y
X(CO) = 0.90. Aplicamos de nuevo la ecuación de la constante de equilibrio de la que despejamos P:
P = (0.10·10)/(0.90)2 = 1.2 atm.
6.- En un recipiente se introduce cierta cantidad de carbamato amónico, NH4CO2NH2 sólido que se disocia en amoniaco y dióxido de carbono cuando se evapora a 25ºC. Sabiendo que la constante Kp para el equilibrio
NH4CO2NH2(s) <--> 2 NH3(g) + CO2(g)
y a esa temperatura vale 2,3·10-4 . Calcular Kc y las presiones parciales en el equilibrio.
Escribimos de nuevo el equilibrio con los moles presentes:
NH4CO2NH2(s) <--> 2 NH3(g) + CO2(g)
n - x 2x x
Este es un equilibrio heterogéneo y en la expresión de la constante solo intervienen los dos gases amoniaco y dióxido de carbono, pero además la presión de amoniaco es dos veces la del dióxido, luego
Kp = 2.3·10-4 = (PNH3 )2 · PCO2 = 4·(PCO2 )3 siendo PCO2 = 0.039 atm.
y PNH3 = 0.078 atm.
Y por último calculamos
Kc = Kp = 2.3·10-4 = 1.57·10-8
(RT)Dn (0.082·298)3
Drogodependencia ( 3 de BGU) Realizar un resumen
Guía Pacientes - Todo problema tiene solución
 Los problemas o situaciones problemáticas son normales en nuestra
vida cotidiana y ocurren a diario. Un problema es una situación real o
imaginaria a la que tenemos que dar una solución, pero de la cual no
disponemos en éste momento. Al no encontrar solución a un problema
surge, o se incrementa, el estrés y otros estados emocionales negativos.
Y, si se actúa, sin tener una solución adecuada, se hace de un modo que
no se desea o de forma poco eficaz, o no se actúa al no encontrar
solución.
Los problemas o situaciones problemáticas son normales en nuestra
vida cotidiana y ocurren a diario. Un problema es una situación real o
imaginaria a la que tenemos que dar una solución, pero de la cual no
disponemos en éste momento. Al no encontrar solución a un problema
surge, o se incrementa, el estrés y otros estados emocionales negativos.
Y, si se actúa, sin tener una solución adecuada, se hace de un modo que
no se desea o de forma poco eficaz, o no se actúa al no encontrar
solución.El entrenamiento en solución de problemas consiste en un procedimiento por el que se entrena a las personas a reconocer sus problemas, buscar soluciones adecuadas a los mismos e implantar la mejor solución en la situación donde ocurre el problema. Este entrenamiento consta de cinco fases: orientación general hacia el problema; definición y formulación del problema; generación de soluciones alternativas; toma de decisiones; y, puesta en práctica y verificación de la solución.
Dado que en el entrenamiento en solución de problemas para pasar de un paso a otro se tiene que superar previamente el anterior. Cuando en un paso no hay suficiente información puede que se haya infravalorado o saltado una fase previa, se esté en una fase de entrenamiento, o la solución elegida no sea la adecuada. En este caso se recomienda volver a la fase o fases previas, para que una vez que haya sido realizada correctamente se pueda continuar con las siguientes.
Una vez que ha decidido la mejor solución para el problema tiene que pasar a poner en práctica la misma y verificar si en la vida real es efectivamente la más adecuada. Cuando la comparación entre el resultado esperado de la solución y el observado coinciden entonces se ha encontrado una solución satisfactoria al mismo. Pero en algunos casos esto no es así. Cuando existen discrepancias suele ser debido a dificultades en el proceso de solución de problemas o en la ejecución de la solución. Si ocurre esto hay que volver a las fases previas del entrenamiento en solución de problemas y comprobar si se ha definido claramente el problema, se han generado todas las alternativas posibles de solución, se ha elegido la solución adecuada de solución y se ha puesto en práctica la misma.
Leyes de los Gases: (3 de BGU y 2 de BGU) Realizar un esqema de las leyes de los gases en su cuaderno.
LEY DE BOYLE Y MARIOTTE:
Ahora
veremos como se relaciona la presión de un gas, en función de su
volumen. Un ejemplo sencillo que puede ayudarte es cuando tienes un
globo inflado a temperatura ambiente y le hace fuerza con nuestra mano
desde el exterior. Notaremos que la deformación del globo hace que el
volumen se achique y que a su vez se observe cierta tensión sobre la
pared interior del mismo. Ese cambio es consecuencia de un aumento de
presión interna, lo que nos permite inferir que en un recipiente cuando disminuimos su volumen la presión aumenta. Hablando con mas propiedad, definiremos que a temperatura constante, la presión que ejerce de un gas ideal es directamente proporcional al volumen que ocupa.
La
expresión de este comportamiento de los gases en Física se conoce con
el nombre de ley de Boyle-Mariotte y matemáticamente se expresa por esta
fórmula: donde los subíndices i y f indican, respectivamente, las
condiciones iniciales y finales del proceso.
Ejemplo: En
el recipiente de abajo, el volumen es de 45 litros y la presión inicial
es la atmosférica, ósea, 1 atm. ¿Que presión experimentará si bajamos
el émbolo de tal modo que el volumen ahora es de 3 litros?
Volumen Inicial: Vi=45
Volumen Final: Vf=3
Volumen Final: Vf=3
Presión Inicial: Pi=1
Presión Final: ? (incógnita)
Presión Final: ? (incógnita)
Aplicando la formula de la Ley de Boyle – Mariotte es: 1 x 45 = 3 x Pf ==> Pf=(1 x 45)/3=15 atm.
También se puede expresa la Ley d Boyle-Mariotte: A temperatura constante p. v = cte.
Para el caso de aquí abajo
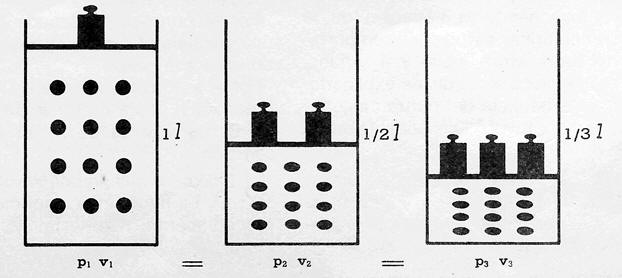
p1.v1=p2.v2=p3.v3
Ley de Boyle-Mariotte: los volúmenes que ocupa una misma masa de gas, a temperatura constante,
son inversamente proporcionales a sus presiones.
Ley de Boyle-Mariotte: los volúmenes que ocupa una misma masa de gas, a temperatura constante,
son inversamente proporcionales a sus presiones.
GRÁFICAMENTE SE PUEDE EXPRESA ASI:
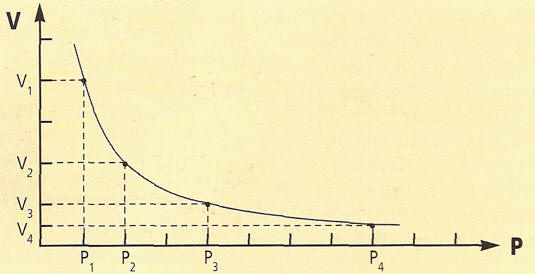
LEY DE BOYLE-MARIOTTE:
Una masa de gas ocupa un volumen que está determinado por la presión y
la temperatura de ese gas. Las leyes de los gases estudian el
comportamiento de una determinada masa de gas, si una de esas magnitudes
permanece constante. Boyle observó que cuando la presión aumentaba, el
volumen se reducía, y, a la inversa, que cuando la presión disminuía, el
volumen aumentaba. De esta manera la ley de Boyle establece que: El volumen de una determinada masa de gas, a temperatura constante, es inversamente proporcional a la presión de ese gas.
LEY DE CHARLES GAY – LUSSAC A PRESIÓN CONSTANTE
En
1787, el físico francés Jacques Charles reflota un viejo postulado
enunciado en 1699 por el francés Guillaume Amontons (1663-1705). Éste
había observado que el volumen de un gas, a presión constante, disminuía
a medida que bajaba la temperatura. La misma comprobación fue realizada
cinco años después por Joseph Gay-Lussac (1778-1850). Amontons queda en
el olvido, y la ley se conoce hoy como ley de Charles y Gay-Lussac. Su
enunciado es el siguiente:
El volumen de una determinada masa gaseosa, a presión constante,
es directamente proporcional a su temperatura absoluta.
es directamente proporcional a su temperatura absoluta.
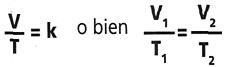
V=volumen y T=temperatura
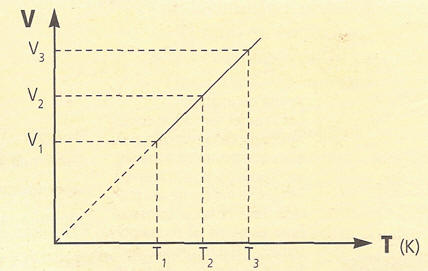
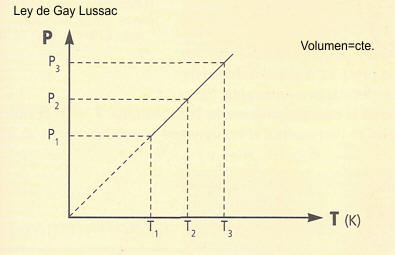
LEY DE CHARLES GAY – LUSSAC A VOLUMEN CONSTANTE
Luego
de varios experimentos, Charles y Gay-Lussac llegaron a la conclusión
de que a volumen constante, la presión aumenta con el aumento de
temperatura. La ley de Charles y Gay-Lussac establece que:
La presión de una determinada masa gaseosa a volumen constante
es directamente proporcional a su temperatura absoluta.
es directamente proporcional a su temperatura absoluta.
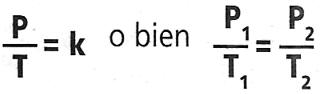
P=presión y T=temperatura
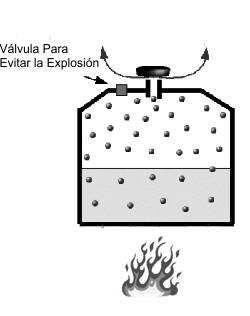
Ejemplo: Cuando se calienta agua en una olla de presión, el volumen no varia, por lo que aumenta
la presión del vapor de agua hasta que el exceso sale por la válvula de seguridad (de lo contrario, explotaría).
la presión del vapor de agua hasta que el exceso sale por la válvula de seguridad (de lo contrario, explotaría).
ECUACIÓN GENERAL DE LOS GASES IDEALES:
La
ley de Boyle y las leyes de Charles y Gay-Lussac pueden relacionarse
matemáticamente mediante la ecuación de estado del gas ideal, que
resulta útil cuando se quiere modificar las tres magnitudes, siempre que
la masa del gas permanezca constante y la temperatura se exprese en
escala Kelvin.
Hasta
ahora hemos visto las siguiente situaciones particulares, llamando a
cada una según el científico que las estudió. Ahora las tres se pueden
unificar en una sola fórmula.
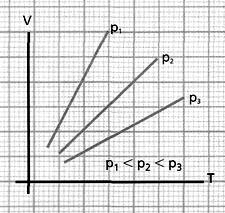
Si
se aumenta la temperatura de un gas, manteniendo su presión constante,
el volumen que ocupa crece proporcionalmente a la temperatura absoluta.
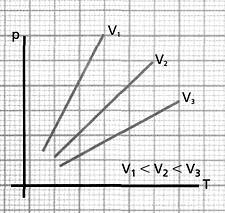 Si
se aumenta la temperatura de un gas, manteniendo su volumen constante,
la presión que el gas ejerce sobre las paredes del recipiente crece
proporcionalmente a la temperatura absoluta.
Si
se aumenta la temperatura de un gas, manteniendo su volumen constante,
la presión que el gas ejerce sobre las paredes del recipiente crece
proporcionalmente a la temperatura absoluta.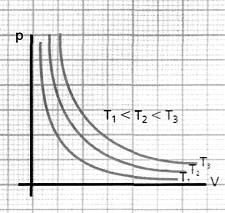 Si se reduce el volumen de un gas, manteniendo su temperatura constante, la presión
Si se reduce el volumen de un gas, manteniendo su temperatura constante, la presióncrece de manera inversamente proporcional al volumen.
Ecuación de estado del gas ideal:
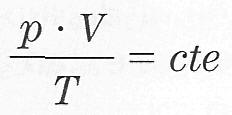
O también:
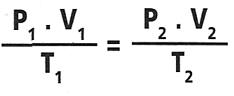
Donde
el valor de la constante depende de la cantidad de gas en cuestión, y T
es la temperatura absoluta (en grados Kelvin). Esta ecuación general de
estado del gas ideal es útil pues relaciona entre sí todas las
variables de estado del sistema. Esto significa que, si conocemos los
valores de dos cualesquiera de ellas, la tercera queda completamente
determinada.
Debe
tenerse en cuenta que las temperaturas han de calcularse en grados
absolutos o Kelvin. Éstas se obtienen sumando 273 a las temperaturas
obtenidas con la graduación centígrada. Así, la temperatura ambiente de
22o se transforma en 295o absolutos o K.
Ejemplo Numérico:
Supongamos un globo que contiene 10 litros de aire a la presión normal,
es decir, a una atmósfera y a la temperatura de 18° centígrados. ¿Cuál
será su volumen si la temperatura aumenta 10°?
Determinemos, primero, las temperaturas inicial y final de este cambio:
Ti = 18°C + 273° = 291 °K
Tf = (18 + 10) °C + 273° = 301 °K
Ti = 18°C + 273° = 291 °K
Tf = (18 + 10) °C + 273° = 301 °K
y, luego, teniendo en cuenta la proporcionalidad directa entre volumen y temperatura,
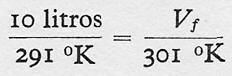
y operando, se tiene: Vf= 10 l. x 301° / 291° = 10,34 litros
¿Cómo podemos resolver un problema en el que varíen simultáneamente el volumen, la presión y la temperatura?
Como
se explicó antes, combinando las leyes anteriores se llega a la
expresión, de Ley de los Gases Perfectos. que nos permite calcular una
de las magnitudes en función de las otras. Así, si queremos calcular el volumen final, despejando, tenemos:
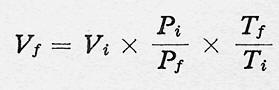
Ecuación General del gas Ideal es:
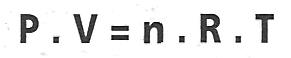
Donde n es el número de moles presentes y R es una constante –cuyo valor depende e las magnitudes y unidades empleadas– igual a 0,082 dm3.
atm / mol . k. Esta ecuación es sumamente interesante si queremos
hallar alguna de las magnitudes y corlemos el resto de las mismas.
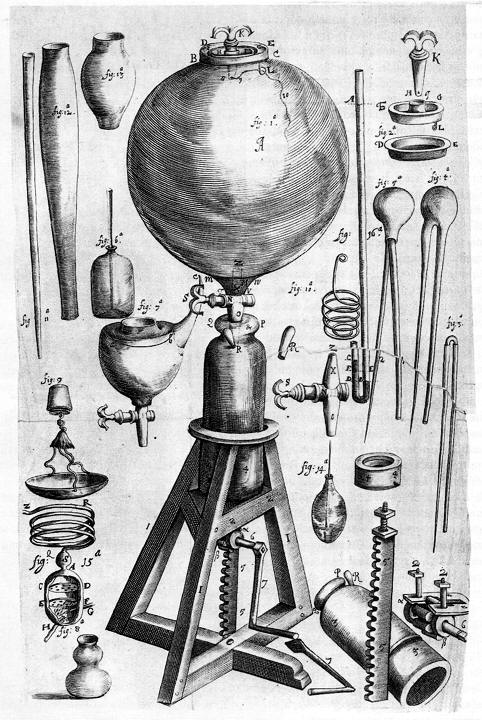
Lámina donde se muestran los instrumentos del laboratorio de Boyle.

Lámina
de «Observations on differents kinds of air» (Philosophical
Transactions ofthe Royal Society, 1772; también aparece en el libro
titulado Experiments and Observations on Differents Kinds of Air
publicado en 1774). de Joseph Priestley, mostrando uno de sus
experimentos para demostrar los efectos de la combustión, putrefacción y
respiración en una planta de menta y en ratones.
Fuente Consultada: QUÍMICA I Polimodal
FÍSICA II Polimodal
CONSULTORA Enciclopedia Temática Ilustrada Tomo 10 El Mundo Físico.
Historia de las Ciencias Desiderio Papp
Balanceo de Ecuaciones Químicas por el método de oxido-reducción (REDOX). ( 1 de BGU) Realizar cinco ejemplos de oxido-redox
Balanceo de Ecuaciones Químicas por el método de oxido-reducción (REDOX).
Antes de dar a conocer los pasos que debemos seguir para balancear una
ecuación química utilizando el método de oxido reducción, recordaremos algunos
conceptos previos, necesarios para el balanceo de ecuaciones químicas.
Reacción química: Es un proceso químico en el cual unas
sustancias, denominadas reactivos,
se transforman en otras nuevas sustancias, denominadas productos. Ejemplo.
Ecuación Química: Es una igualdad en la que se representan en
el primer miembro o parte izquierda de la ecuación símbolos y/o fórmulas de los
reactivos y en el segundo miembro o parte derecha, los productos.
Estado de oxidación ó número de oxidación: Es una expresión del número de electrones que
un átomo ha ganado, perdido ó compartido al unirse con otro.
Oxidación: Es la perdida de electrones, acompañada de un aumento en
el número de oxidación de un elemento hacia un valor más positivo.
Reducción: Es la ganancia de electrones, acompañada de una
disminución en el número de oxidación hacia un valor menos positivo.
Agente oxidante: Es el elemento o compuesto que capta
electrones para reducirse.
Agente reductor: Es el elemento ó compuesto que cede
electrones, oxidándose.
Por ejemplo, cuando el cinc reacciona con el acido clorhídrico, cada átomo de cinc
pierde dos electrones y aumenta su número de oxidación de cero (0)
a mas dos (+2) (oxidándose), por el contrario, el átomo de hidrogeno se reduce al pasar de un estado de oxidación inicial de +1 a uno de
cero (0)
Como podemos ver el cinc se oxida al perder
dos electrones (pasa de un estado de oxidación de 0 a +2) y se comporta como el agente
reductor.
En este ejemplo, el hidrogeno se reduce al
pasar de un estado de oxidación de +1
hasta 0, comportándose como el agente oxidante.
Las reacciones de oxidación y reducción suceden simultáneamente. Toda
reacción de oxidación esta acompañada de una reacción de reducción. Por eso es
que estas reacciones se llaman comúnmente reacciones redox (reducción-oxidación).
Al tener todos estos conceptos bien claro, procedemos entonces a explicar
cada uno de los pasos necesarios para equilibrar una ecuación química.
Tomaremos como ejemplo la siguiente ecuación química.
1. Lo primero que debemos hacer es colocar sobre cada elemento químico su
estado de oxidación correspondiente.
2. Luego de haber colocado el estado de oxidación a cada elemento químico, debemos determinar que elemento se oxida y
cual se reduce.
- Cr, el cromo se oxida al perder tres electrones (pasa de +3 a +6)
- N, el nitrógeno se reduce al ganar dos electrones (pasa de +5 a +3)
- Los demás elementos se mantienen igual dentro de la ecuación.
3. El tercer paso es colocar una flecha bajo el elemento que se oxida,
indicando el número de electrones que pierde.
4. El cuarto paso es colocar una flecha bajo el elemento que se reduce (con
sentido hacia arriba), indicando el numero de electrones que ganó.
Suscribirse a:
Entradas (Atom)