La Teoría de la Evolución Darwin Charles
La Selección Natural
Está
generalmente reconocido que los seres vivos evolucionan y que las
formas sencillas dan lugar a formas cada vez más complejas. ¿Cómo sucede
esto? He aquí la cuestión que intrigó a Carlos Darwin, el gran
naturalista, durante muchos años. Darwin creía firmemente en la
evolución, pero por largo tiempo fue incapaz de explicarla.
Al cabo de muchos años desarrolló su famosa Teoría de la evolución por selección natural,
basada en el modo prodigioso en que los animales se adaptan a su
ambiente. La evolución es el proceso por el que una especie cambia con
el de las generaciones. Dado que se lleva a cabo de manera muy lenta han
de sucederse muchas generaciones antes de que empiece a hacerse
evidente alguna variación.
 UN POCO DE HISTORIA…Desde
la antigüedad, el modo de originarse la vida y la aparición de la gran
variedad de organismos conocidos, constituyó un misterio que, en menor o
mayor medida, despertó curiosidad de los científicos.
UN POCO DE HISTORIA…Desde
la antigüedad, el modo de originarse la vida y la aparición de la gran
variedad de organismos conocidos, constituyó un misterio que, en menor o
mayor medida, despertó curiosidad de los científicos.
Sin
embargo, las supersticiones, los prejuicios, los dogmas religiosos y
las teorías que se aventuraban debido a la imposibilidad de probarlas
con el nivel de conocimiento de aquellas épocas, hicieron que la
cuestión quedara a menudo en el olvido o que, simplemente, se aceptara
la imposibilidad de averiguar los orígenes.
No
fue hasta épocas relativamente recientes cuando el hombre pudo
finalmente abordar esta cuestión con unos criterios fiables y unos
conocimientos científicos suficientes para demostrar sus hipótesis
Es así como podemos afirmar, que antes del siglo XIX existieron diversas
hipótesis que intentaban explicar justamente esta cuestión, “el origen de la vida sobre la Tierra”.
Las teorías creacionistas que hacían referencia a un hecho puntual de
la creación divina; y por otra parte, las teorías de la generación
espontánea que defendían que la aparición de los vivos se producía de
manera natural, a partir de la materia inerte.
Una primera aportación científica sobre el tema es el trabajo de Oparin (1924), El origen de la vida sobre la Tierra,
donde el bioquímico y biólogo ruso propone una explicación, vigente aún
hoy, de la manera natural en que de la materia surgieron las primeras
formas pre-biológicas y, posteriormente el resto de los seres vivos. En
segundo aspecto de la generación espontánea de la vida tiene una
respuesta convincente desde mediados del siglo XIX.
Esto es así, gracias a Pasteur y
fundamentalmente a Darwin quienes realizaron experimentos al respecto.
Este último, naturalista británico realizó una obra de vital
trascendencia (1859): El origen de las especies. La cual tiene por objetivo aportar una explicación científica sobre la evolución o denominada “descendencia con modificación” (término utilizado para explicar estos fenómenos).
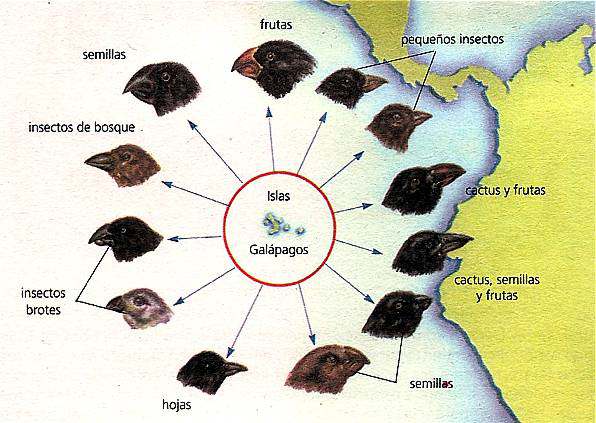
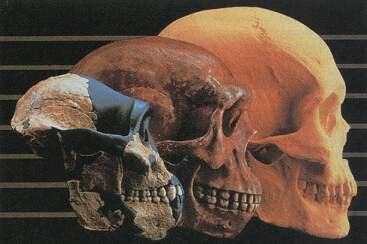
Los
pinzones de Darwin son un grupo de pájaros que se encuentran en las
islas Galápagos y que contribuyeran grandemente a ¡a formación de la
teoría de la evolución. En esas islas existen pocas aves de otra de otra
clase y los pinzones han evolucionado en varias direcciones, de modo
que ahora los hay granívoros, frugívoros, insectívoros, etc. Sus picos
varían de forma, de acuerdo con le función. Se distinguen varias
especies y subespecies. La semejanza general entre ellos sugiere que han
evolucionado recientemente, a partir de un antepasado común.
Evolución de los pinzones de Darwin
Sin
lugar a dudas que existieron importantes antecedentes del tema, aunque
siempre se manifiesta el honor de haber realizado esta teoría de manera
científica e inexorable, a Charles Darwin. No muy lejos, fue su abuelo
–Erasmo Darwin- quien aportó las primeras muestras de interés científico
por estos temas. No obstante, quien fue precursor de una corriente de
pensamiento sobre el estudio de la evolución de los seres vivos, es Jean
Baptiste de Monet, caballero de Lamarck (1744-1829).
Su tesis fundamental es la transmisión de los caracteres adquiridos como origen de la evolución
(es decir, que las características que un individuo adquiere en su
interacción con el medio se transmiten después a su descendencia);
denominada este principio como Lamarckismo.
La
causa de las modificaciones de dichos caracteres se encuentra en el uso
o no de los diversos órganos, tesis que se resume en la siguiente
frase: «La función crea el órgano». Lamarck resume sus ideas en Filosofía zoológica (1809), el primer trabajo científico donde se expone de manera clara y razonada una teoría sobre la evolución.
Así,
por ejemplo, los lamarckistas explicaban la aparición del cuello largo
en las jirafas como un proceso paulatino de adaptación de un animal a ir
comiendo hojas situadas cada vez más altas. Lo que supondría que sus
hijos heredarían un cuello más largo aún.
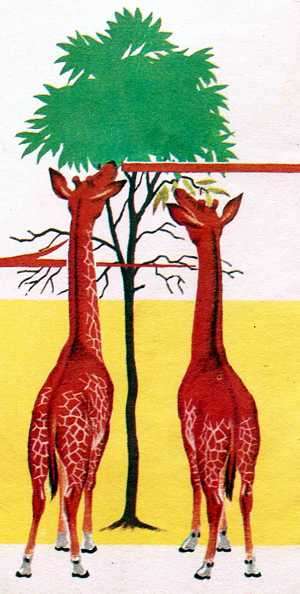
Lemack
suponía que el esfuerzo de las jirafas para alcazar la hojas mas altas,
hacía que sus cuellos se estirasen unos centímetros, y que luego ese
estiramiento era transmitido a sus descendientes.Las ideas de Lamarck
fueron criticadas por Weissman, quien posteriormente demostró que los
caracteres adquiridos no pueden heredarse. Las células del cuerpo (o
somáticas) están completamente separadas de las reproductoras (gametos:
óvulos y espermatozoides) y solamente estas últimas transmiten rasgos
hereditarios a la generación siguiente.
En realidad según la teoría de Darwin
las que tenían el cuello y las patas algo más largos que las otras,
podrían alimentarse de hojas de acacia, (las otras se desnutrían) lo que
les ayudaría a sobrevivir mejor en las épocas de sequía. Actuó de esta
manera la selección natural, que permitió a los mejor adaptados, los más altos, reproducirse.

Lamarck,
que vivió de 1744 a 1829. De acuerdo con ella, si un hombre hace
gimnasia intensamente y desarrolla sus músculos, sus hijos tendrán
también músculos potentes. En otras palabras, los caracteres adquiridos
durante la vida de un individuo pueden ser heredados. Esta teoría
recibe, por ello, el nombre de teoría de la herencia de los caracteres adquiridos.
Evidentemente, es cierto que los músculos pueden ser desarrollados
mediante ciertos ejercicios, pero lo que no está demostrado en absoluto
es que estas modificaciones puedan heredarse.
En lo que respecta al científico británico, Charles Darwin, viajando a bordo del Beagle,
durante largos años (1831- 1836) recogió datos botánicos, zoológicos y
geológicos que le permitieron establecer un conjunto de hipótesis que
cuestionaban las ideas precedentes sobre la generación espontánea de la
vida