Símbolos de Lewis
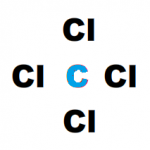
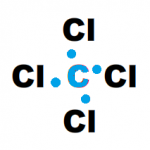
Para empezar con estructura de lewis, es importante comprender estos símbolos que son una representación gráfica de la ubicación de los electrones en un átomo. Se colocan los electrones de valencia como puntos alrededor del símbolo del elemento.
Regla del Octeto
Los átomos se unen compartiendo electrones hasta completar la última capa con 8 electrones (4 pares) con lo que alcanzan la configuración de gas noble: ns2np6. Esto se conoce como la regla del octeto.
Estructuras de Lewis o de electrón-punto
La forma más sencilla de simbolizar la estructura electrónica y el enlace en una molécula es mediante estructuras de Lewis. En estas estructuras, cada electrón de valencia se representa mediante un punto, o cada par de electrones mediante una línea.
| CONFIGURACIÓN ELECTRÓNICA | SÍMBOLO DE LEWIS | |
| Li | [He] 2s1 | |
| Be | [He] 2s2 | |
| B | [He] 2s2 2p1 | |
| C | [He] 2s2 2p2 | |
| N | [He] 2s2 2p3 | |
| O | [He] 2s2 2p4 | |
| F | [He] 2s2 2p5 | |
| Ne | [He] 2s2 2p6 |
Para dibujar lo que es la estructura de Lewis
- Se dibuja el esqueleto molecular colocando los símbolos de los elementos. En general el átomo menos electronegativo ocupa la posición central.
- Se colocan los electrones de valencia del átomo central alrededor del mismo.
- Se distribuyen los electrones de los átomos que rodean al átomo central, teniendo en cuenta la regla del octeto. Los átomos individuales se combinan tendiendo a tener completa la última capa de electrones. Es decir a adquirir la configuración electrónica del gas noble más próximo.
- Para conseguir que se cumpla la regla del octeto en algunos casos puede ser necesario utilizar enlaces múltiples. Por ejemplo para la molecula de dioxido de carbono CO2 su estructura de Lewis es la siguiente.
TAREA
1. REALIZAR EN SU CUADERNO UN MAPA CONCEPTUAL SOBRE ESTE TEMA O DE LA LAS PAGINAS 70 Y 71 DEL TEXTO
2. EN UNA HOJA PERFORADA REALIZAR DIEZ EJERCICIOS SOBRE LA CLASE DE AYER.