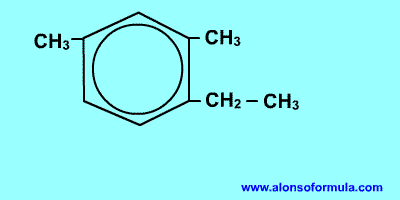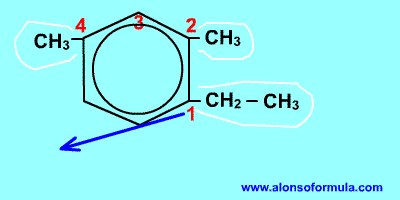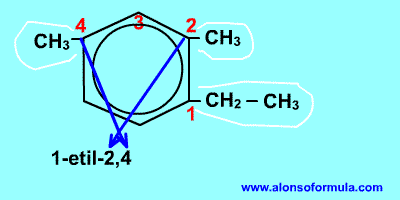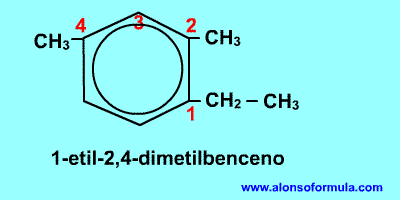
Un poco de historia
Que la Tierra tiene forma esférica es
una aportación que se gestó en la Grecia clásica dejando de lado
concepciones cosmológicas antiguas, como la de la civilización
mesopotámica, que consideraban que el mundo era una especie de isla
plana flotando en el agua cubierto por una cúpula de cielo.
La escuela pitagórica
pensaba que la Tierra era esférica, en la Academia de Platón (427-347
a.C.) también se participaba de la misma idea, aunque de forma ambigua;
Platón decía en el Timeo que Dios hizo el mundo en forma de
globo. Pero fue Aristóteles (384-322 a.C.) el que aportó argumentos
físicos a favor de la esfericidad de la Tierra tales como la forma
circular de la sombra de la Tierra en los eclipses de Luna o el
testimonio de los comerciantes griegos que viajaban hacia el sur, que
observaban las constelaciones más altas sobre el horizonte a medida que
avanzaban.
A partir del siglo V a. C.
todos pensaban en Grecia que la Tierra tenía forma esférica, pero hasta
el siglo III, no se tuvo una idea clara del tamaño y forma de la Tierra.
El astrónomo y matemático Eratóstenes de Cirene (276-194 a. C.) midió
el radio de la Tierra. Eratóstenes fue un filósofo de gran prestigio,
fue director de la Biblioteca de Alejandría y trabajó en el problema de
la duplicación del cubo y en los números primos. Tuvo abundante relación
epistolar con Arquímedes, que fue el científico más grande de la
antigüedad, como se pope de manifiesto en la obra El Método del sabio de Siracusa.
Medida del radio de la Tierra
Eratóstenes partía de la base, como la
mayor parte de los griegos, de que la Tierra era esférica y, además
tenía la idea de que, a efectos prácticos, como el Sol estaba muy lejos
de la Tierra, sus rayos llegaban paralelos independientemente del lugar
de la Tierra dónde nos encontremos.

Eratóstenes
tenía los datos para calcular el radio de la Tierra en la propia
Biblioteca de Alejandría. El dato fundamental estaba en un informe que
decía que en la ciudad de Siena, que distaba 800 Km. al sureste de
Alejandría, en el mediodía del solsticio de verano (21 de Junio), los
rayos solares no producían sombra al caer sobre una vara perpendicular
al suelo.
Otra versión de esta observación es que
un viajero le contó a Eratóstenes que en Siena había un pozo profundo,
al que sólo le llegaban los rayos solares al fondo el día de solsticio
de verano.
Ambas versiones significan que el día
del solsticio de verano los rayos del Sol llegan a la Tierra paralelos
entre sí y perpendiculares al suelo

Eratóstenes
midió la sombra que proyectaba una vara vertical en Alejandría, el
mediodía del día del solsticio de verano sabiendo que en ese momento los
rayos solares caían verticalmente en Siena (Alejandría y Siena estaban
casi en el mismo meridiano).
Si la Tierra fuera plana, suponiendo que
el Sol está muy lejos y sus rayos llegan paralelos entre sí y
perpendiculares a la superficie terrestre, objetos iguales deberían
proyectar sombras iguales a la misma hora del mismo día, con
independencia del lugar en que se encuentren.
Al realizar la medición en Alejandría
Eratóstenes observó que los rayos solares formaban con la vertical un
ángulo de 7º 12’. Lo que confirmaba que la Tierra no era plana y,
suponiendo que tenía forma esférica, calculó utilizando la distancia
entre Alejandría y Siena y la medida del ángulo de inclinación de los
rayos solares en Alejandría, que la circunferencia de la Tierra medía
aproximadamente 250.000 estadios. (1 estadio=160m), es decir unos 40.000
kilómetros. Lo que representa una precisión considerable, dada las
limitaciones de la época para medir distancias en la superficie
terrestre y ángulos
Evidentemente, el cálculo lo realizó con una sencilla regla de tres:
7º 12’ ——————- 800 km
360º ————- Circunferencia de la Tierra
De donde: Circunferencia de la Tierra = 40.000 km.
Y como tenemos que 40.000=2·π·R
De dónde tenemos que el radio de la tierra calculado por Eratóstenes era R=6369 km.