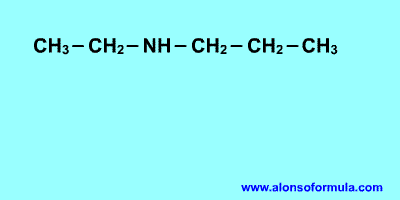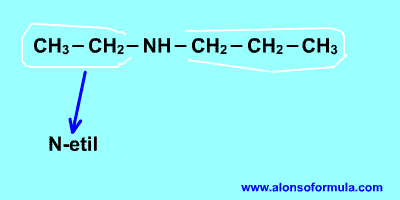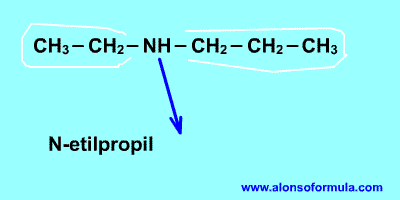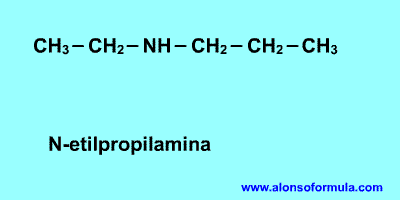
Qué es la diabetes?
La diabetes es una afección crónica que se desencadena cuando el organismo pierde su capacidad de producir suficiente insulina o de utilizarla con eficacia. 1 La insulina es una hormona que se fabrica en el páncreas y que permite que la glucosa de los alimentos pase a las células del organismo, en donde se convierte en energía para que funcionen los músculos y los tejidos. Como resultado, una persona con diabetes no absorbe la glucosa adecuadamente, de modo que ésta queda circulando en la sangre (hiperglucemia) y dañando los tejidos con el paso del tiempo. Este deterioro causa complicaciones para la salud potencialmente letales.Hay tres tipos principales de diabetes:
- diabetes tipo 1
- diabetes tipo 2
- diabetes mellitus gestacional (DMG)
Diabetes tipo 1
La diabetes tipo 1 está causada por una reacción autoinmune, en la
que el sistema de defensas del organismo ataca las células productoras
de insulina del páncreas. Como resultado, el organismo deja de producir
la insulina que necesita. La razón por la que esto sucede no se acaba de
entender. La enfermedad puede afectar a personas de cualquier edad,
pero suele aparecer en niños o jóvenes adultos. Las personas con esta
forma de diabetes necesitan inyecciones de insulina a diario con el fin
de controlar sus niveles de glucosa en sangre. Sin insulina, una persona
con diabetes tipo 1 morirá.La diabetes tipo 1 suele desarrollarse repentinamente y podrían presentarse síntomas como:
- sed anormal y sequedad de boca
- micción frecuente
- cansancio extremo/falta de energía
- apetito constante
- pérdida de peso repentina
- lentitud en la curación de heridas
- infecciones recurrentes
- visión borrosa
El número de personas que desarrollan diabetes tipo 1 aumenta cada año. Las razones para que esto suceda siguen sin estar claras, pero podría deberse a los cambios de los factores de riesgo medioambiental, a circunstancias durante el desarrollo en el útero, a la alimentación durante las primeras etapas de la vida o a infecciones virales.
Diabetes tipo 2
La diabetes tipo 2 es el tipo más común de diabetes. Suele aparecer en adultos, pero cada vez más hay más casos de niños y adolescentes. En la diabetes tipo 2, el organismo puede producir insulina pero, o bien no es suficiente, o el organismo no responde a sus efectos, provocando una acumulación de glucosa en la sangre.Las personas con diabetes tipo 2 podrían pasar mucho tiempo sin saber de su enfermedad debido a que los síntomas podrían tardar años en aparecer o en reconocerse, tiempo durante el cual el organismo se va deteriorando debido al exceso de glucosa en sangre. A muchas personas se les diagnostica tan sólo cuando las complicaciones diabéticas se hacen patentes (ver Complicaciones diabéticas).
Aunque las razones para desarrollar diabetes tipo 2 aún no se conocen, hay varios factores de riesgo importantes. Éstos son:
- obesidad
- mala alimentación
- falta de actividad física
- edad avanzada
- antecedentes familiares de diabetes
- origen étnico
- nutrición inadecuada durante el embarazo, que afecta al niño en desarrollo
El número de personas con diabetes tipo 2 está en rápido aumento en todo el mundo. Este aumento va asociado al desarrollo económico, al envejecimiento de la población, al incremento de la urbanización, a los cambios de dieta, a la disminución de la actividad física y al cambio de otros patrones de estilo de vida. 2
Diabetes mellitus gestacional
Se dice que una mujer tiene diabetes mellitus gestacional (DMG) cuando se le diagnostica diabetes por primera vez durante el embarazo. Cuando una mujer desarrolla diabetes durante el embarazo, suele presentarse en una etapa avanzada y surge debido a que el organismo no puede producir ni utilizar la suficiente insulina necesaria para la gestación.
Ya que la diabetes
gestacional suele desarrollarse en una etapa avanzada de la gestación,
el bebé ya está bien formado, aunque siga creciendo. El riesgo para el
bebé es, por lo tanto, menor que los de cuyas madres tienen diabetes
tipo 1 o tipo 2 antes del embarazo. Sin embargo, las mujeres con DMG
también deben controlar sus niveles de glucemia a fin de minimizar los
riesgos para el bebé. Esto normalmente se puede hacer mediante una dieta
sana, aunque también podría ser necesario utilizar insulina o
medicación oral.
La diabetes gestacional de la madre suele desaparecer tras el parto.
Sin embargo, las mujeres que han tenido DMG corren un mayor riesgo de
desarrollar diabetes tipo 2 con el paso del tiempo. Los bebés nacidos de
madres con DMG también corren un mayor riesgo de obesidad y de
desarrollar diabetes tipo 2 en la edad adulta.Alteración de la tolerancia a la glucosa y alteración de la glucosa en ayunas
Se dice que las personas con altos niveles de glucemia, que no llegan a ser los de las personas con diabetes, tienen alteración de la tolerancia a la glucosa (ATG) o alteración de la glucosa en ayunas (AGA). La ATG se define como niveles altos de glucemia tras las comidas, mientras que la AGA se define como un alto nivel de glucemia tras un ayuno.
Las personas con ATG
corren un mayor riesgo de desarrollar diabetes tipo 2. No es
sorprendente que la ATG comparta muchas características con la diabetes
tipo 2 y vaya asociada a la obesidad, la edad avanzada y la incapacidad
del organismo de utilizar la insulina que produce. Sin embargo, no todo
el mundo con ATG llega a desarrollar diabetes tipo 2.