Configuración electrónica
Vamos a estudiar la
configuración electrónica
o también llamada
distribución electrónica. Abajo del todo
tienes una tabla con la configuración electrónica de todos los elementos,
pero aqui vamos a explicarte como se hace.
Primero te vamos a explicar todo de forma sencilla para que lo
entiendas. Luego te enseñaremos una regla muy sencilla
para obtener la
configuración electrónica de cualquier elemento, pero es bueno que intentes
entender el cómo y el por qué. Por eso empezaremos por el principio para
que nos resulte fácil.
Introducción
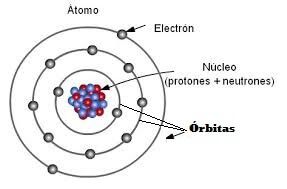
Recuerda que lo átomos tienen un núcleo donde se encuentran los protones
y los neutrones, pero alrededor del núcleo están los electrones girando en
las llamadas órbitas. Un átomo puede tener varias órbitas alrededor de su
núcleo y sobre las cuales están girando sus electrones.
¿Qué es la Configuración Electrónica?
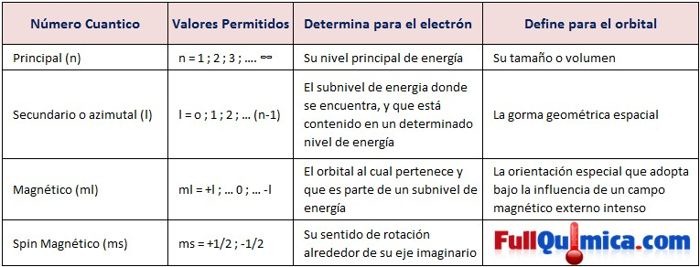
La Configuración o Distribución electrónica nos dice como están ordenados los electrones
en los distintos niveles de energía (órbitas), o lo que es lo mismo como están
distribuidos los electrones alrededor del núcleo de su átomo.
¿Cómo saber los electrones que tienen los átomos en cada
una de sus órbita?
Pues bien, eso es lo que se llama la configuración electrónica de un
elemento de la tabla periódica. Poco a poco lo iremos aprendiendo.
¿Para que queremos saber esto?. Por ejemplo, es muy útil
o mejor dicho imprescindible para hacer el
enlace covalente y los
enlaces iónicos y conocer los llamados
electrones de valencia, que
son
el número de electrones que tiene el átomo de un elemento en su última capa
u órbita
(subnivel).
Lo primero,
cuanto más alejado del núcleo esté girando el electrón
mayor es su nivel de energía.
Los electrones, de un átomo, que tengan la
misma energía se dice que están en el mismo
nivel de energía. Estos niveles
de energía también se llaman
orbitales de energía.
Orbitales de Energía
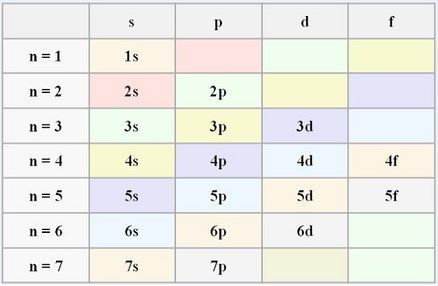
En la actualidad la periferia del núcleo (su alrededor) se divide
en
7 niveles de energía diferentes, numerados del 1 al 7, y en los que
están distribuidos los electrones, lógicamente en orden según su nivel de energía.
Los electrones con menos energía estarán girando en el nivel 1.
Pero además
cada nivel se divide en subniveles. Estos
subniveles en los que se divide cada nivel
pueden llegar a ser hasta 4. A
estos 4 subniveles se les llama:
s, p, d, f.
Resumen: niveles de energía hay del 1 al 7 y subniveles hay 4 el s, p,
d y el f.
OJO hay átomos que no tienen los 4 subniveles, como veremos más
adelante, y átomos que no tienen los 7 niveles de energía, pueden tener menos. Esto es
precisamente lo que queremos averiguar,
cuantos
niveles y subniveles de energía tiene un átomo concreto y cuantos
electrones tiene en cada uno de estos subniveles y niveles, es decir su
Configuración Electrónica.
Además, hay algo muy importante,
en cada subnivel solo podemos tener un número máximo de
electrones. Esto hace que podamos saber el número de electrones
fácilmente, o lo que es lo mismo la distribución electrónica.
En el subnivel s solo puede haber como máximo
2 electrones, en el p 6, en el d 10 y en el f 14. (en cada nivel hay 4 más que
en el nivel anterior, es fácil de recordar). Veámoslo con una
imagen.
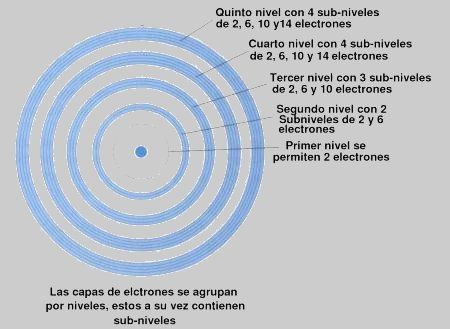
Fíjate en la imagen que en el nivel 1 (no se aprecia el círculo en
la imagen pero está ahí) solo se permiten 2 electrones girando en ese
nivel y además solo tiene un subnivel, el s. No hay ningún átomo que tenga más de 2 electrones girando en el
primer nivel de energía (puede tener 1 o 2 átomos).
Si ahora pasamos al nivel 2, vemos que tiene 2 subniveles,
lógicamente el s y el p. Pero claro en el nivel s solo habrá como máximo 2
electrones y en el p como máximo 6. Si seguimos viendo la imagen nos
daremos cuenta de lo siguiente.
¡¡¡IMPORTANTE NIVELES Y
SUBNIVELES!!!
Fíjate que fácil: En el nivel 1 hay un subnivel, en el 2, 2 subniveles,
en el 3, 3 subniveles y en el 4 hay 4 subniveles. ¿Fácil NO?. Los últimos
niveles un poco diferentes, por ejemplo en el 5, hay 4 subniveles, no puede
tener más porque solo existen 4. Y ahora vamos a contar al revés, en el
nivel 6, 3 subniveles y en el último nivel, el 7 solo habrá...¿Cuantos?
Pues si, habrá 2 subniveles.
Además, si hay un subnivel siempre será el s, si hay 2 serán el s y
el p, si hay 3 serán el s, el p y el d, y si hay 4 subniveles serán el s,
el p, el d y el f.
Concretemos más nivel a nivel:
- Primero de todo, recordar que en el subnivel s solo puede haber como máximo 2
electrones, en el p 6, en el d 10 y en el f 14. En cada nivel tendremos:
- En el nivel 1 solo hay un subnivel, y lógicamente será el s.
- El nivel 2 hay
2 subniveles, el s y el p.
- En el nivel 3 hay 3 subniveles el s, el p y el d.
- En el
nivel 4 hay 4 subniveles, el s, el p, el d y el f.
Pero OJO el nivel 5
tiene 4 subniveles también, pero en el nivel 6 solo tiene 3 (hasta el d) y
en el 7 solo dos subniveles el s y el p.
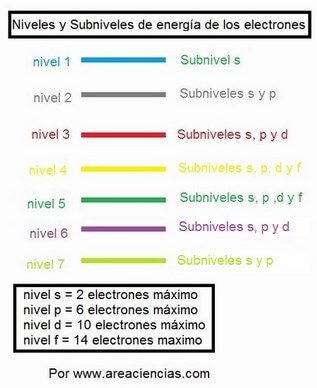
Fíjate como quedarían cada nivel: