Ácidos y bases de Arrhenius
Puntos más importantes
- Un ácido de Arrhenius es cualquier especie que aumenta la concentración de start text, H, end text, start superscript, plus, end superscript en una solución acuosa.
- Una base de Arrhenius es cualquier especie que aumenta la concentración de start text, O, H, end text, start superscript, minus, end superscript en una solución acuosa.
- En solución acuosa, los iones start text, H, end text, start superscript, plus, end superscript reaccionan inmediatamente con las moléculas de agua para formar iones hidronio, start text, H, end text, start subscript, 3, end subscript, start text, O, end text, start superscript, plus, end superscript.
- En una reacción ácido-base o reacción de neutralización, un ácido y una base de Arrhenius reaccionan generalmente para formar agua y una sal.
Introducción
¡Del vinagre en tu despensa hasta el jabón en la ducha, los ácidos y bases están por todas partes! Pero ¿qué significa decir que algo es ácido o básico? Para responder a esta pregunta, necesitamos examinar algunas de las teorías que describen los ácidos y las bases. En este artículo, nos centraremos en la teoría de Arrhenius.
Los ácidos de Arrhenius
La teoría de ácidos y bases de Arrhenius fue propuesta originalmente por el químico sueco Svante Arrhenius en 1884, quien sugirió clasificar ciertos compuestos como ácidos o bases de acuerdo con el tipo de iones que se forman cuando el compuesto se añade al agua
Un ácido de Arrhenius es cualquier especie que aumenta la concentración de iones
start color #1fab54, start text, H, end text, start superscript, plus, end superscript, end color #1fab54 (o protones) en solución acuosa. Por ejemplo, consideremos la reacción de disociación para el ácido clorhídrico, start text, H, C, l, end text, en agua:
Cuando hacemos una solución acuosa de ácido clorhídrico, el start color #1fab54, start text, H, end text, end color #1fab54, start text, C, l, end text se disocia en iones start color #1fab54, start text, H, end text, start superscript, plus, end superscript, end color #1fab54 y start text, C, l, end text, start superscript, minus, end superscript. Ya que esto resulta en un aumento en la concentración de iones start color #1fab54, start text, H, end text, start superscript, plus, end superscript, end color #1fab54 en solución, el ácido clorhídrico es considerado un ácido de Arrhenius.
¿Iones hidrógeno o iones hidronio?
Supongamos que preparamos una solución acuosa 2 M de ácido bromhídrico, start text, H, B, r, end text, que es un ácido de Arrhenius. ¿Quiere decir esto que tenemos 2 M de iones start text, H, end text, start superscript, plus, end superscript en la solución?
En realidad, no. En la práctica, los protones cargados positivamente reaccionan con las moléculas de agua circundantes para formar iones hidronio, start text, H, end text, start subscript, 3, end subscript, start text, O, end text, start superscript, plus, end superscript. Esta reacción se puede escribir como sigue:
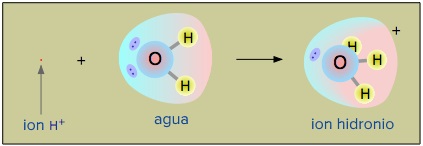
Aunque a menudo escribimos las reacciones de disociación ácida mostrando la formación de start text, H, end text, start superscript, plus, end superscript, left parenthesis, a, c, right parenthesis, no hay iones start text, H, end text, start superscript, plus, end superscript libres flotando en una solución acuosa. En realidad, son iones start text, H, end text, start subscript, 3, end subscript, start text, O, end text, start superscript, plus, end superscript principalmente, que se forman de manera inmediata cuando un ácido se disocia en agua. La imagen siguiente muestra mediante el uso de modelos moleculares, la formación de iones hidronio a partir de agua y de iones de hidrógeno:
En la práctica, la mayoría de los químicos hablan de la concentración de start text, H, end text, start superscript, plus, end superscript y la concentración de start text, H, end text, start subscript, 3, end subscript, start text, O, end text, start superscript, plus, end superscript indistintamente. Cuando queremos ser más precisos y menos perezosos, podemos escribir la reacción de disociación del ácido bromhídrico para mostrar explícitamente la formación de iones hidronio en lugar de protones:
TAREA
1. LEA EL TEXTO EN LAS PÁGINAS 174 Y 175. Y REALICE UN MAPA CONCEPTUAL
2. DE LA PAGINA 175 EN UNA HOJA PERFORADA REALICE DOS DE LAS TRES ACTIVIDADES
3 . QUERIDOS ESTUDIANTES RECUERDEN ENVIAR LAS TAREAS NUMERADAS Y
CON FECHAS PARA UNA MEJOR EVALUACIÓN. AGRADEZCO LAS TAREAS ENVIADAS POR PARTE
DE USTEDES Y NUEVAMENTE LES ENVIO EL LISTADO DE TODOS LOS DOCENTES DE LA
JORNADA NOCTURNA CON LA FINALIDAD QUE SI TIENE ALGUNA DUDA DE ALGÚN TEMA EN
PARTICULAR LE PUEDAN PREGUNTAR Y ESTAR EN CONTACTO CON LOS DOCENTES. (RECUERDEN
GUARDAR TODAS LAS TAREAS EN FISICO)
LISTADO DE DOCENTES
JORNADA NOCTURNA
|
UNIDAD
EDUCATIVA OCTAVIO CORDERO PALACIOS
|
|||
|
N°
|
APELLIDOS Y NOMBRE
|
CELULAR
|
CORREO
|
|
1
|
ASTUDILLO BEATRIZ
|
0990984289
|
|
|
2
|
CASTILLO MARIA DOLORES
|
0999029802
|
|
|
3
|
CORDOVA MANUEL
|
0980210744
|
|
|
4
|
CHUMBAY WILFRIDO
|
0939823869
|
|
|
5
|
GUAZHAMBO ANGEL
|
0986159280
|
|
|
6
|
GUERRON WASHINGTON
|
0998089077
|
|
|
7
|
MINGA GARCIA ANDRES FELIPE
|
0995981909
|
|
|
8
|
MONCERRATE JUAN CARLOS
|
0999523611
|
|
|
9
|
MOROCHO FAREZ DEYSI MARITZA
|
0989856677
|
|
|
10
|
OCHOA CHICA SARA CARMITA
|
0980345995
|
|
|
11
|
OJEDA OJEDA FANNY ESPERANZA
|
0987572387
|
|
|
12
|
OLMEDO CALVA LUPITA
|
0967553158
|
|
|
13
|
PERALTA BERMUDEZ DIEGO PATRICIO
|
0998380848
|
|
|
14
|
QUITO PIEDRA JOSE
|
0980373282
|
|
|
15
|
VELEZ PEÑA CARLOS ALEJANDRO
|
0999425977
|
|
|
16
|
JIMBO LILIANA
|
0983533121
|
|
|
16
|
|
|
|
NOTA. EL DÍA VIERNES NO HABRÁ BLOG CON LA FINALIDAD QUE SE IGUALEN
ALGUNAS TAREAS QUE LES FALTA ENTREGAR. Y SIEMPRE ADELANTE SOMOS OCTAVINOS DE
CORAZÓN.
SALUDOS CORDIALES Y
RECUERDE “QUÉDESE EN CASA POR SU SALUD Y LA DE LOS SUYOS”
No hay comentarios:
Publicar un comentario