La estructura de Lewis es toda aquella representación de los enlaces covalentes dentro de una molécula o un ion. En ella, dichos enlaces y los electrones se representan con puntos o guiones largos, aunque la mayoría de las veces los puntos corresponden a los electrones no compartidos y los guiones a los enlaces covalentes.
Pero, ¿qué es un enlace covalente? Es la compartición de un par de electrones (o puntos) entre dos átomos cualquiera de la tabla periódica. Con estos diagramas se pueden bosquejar muchos esqueletos para un determinado compuesto. Cuál de ellos es el correcto dependerá de las cargas formales y de la naturaleza química de los mismos átomos.
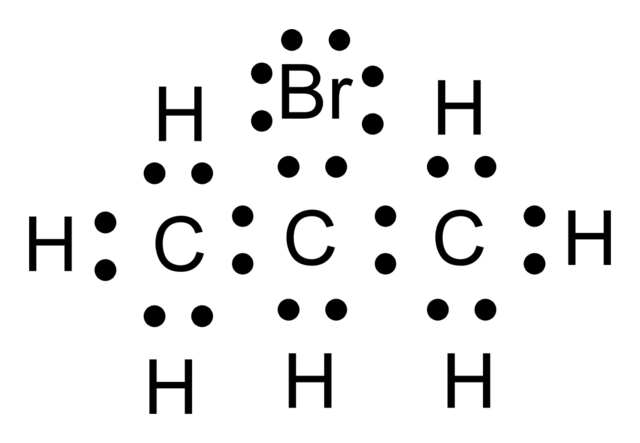
En la imagen superior se tiene un ejemplo de lo que es una estructura de Lewis. En este caso el compuesto representado es el 2-bromopropano. Pueden apreciarse los puntos negros correspondientes a los electrones, tanto los que participan en los enlaces como los no compartidos (el único par justo arriba del Br).
Si los pares de puntos “:” se sustituyeran por un guion largo “–“, entonces el esqueleto carbonado del 2-bromopropano se representaría como: C–C–C. ¿Por qué en lugar del “armazón molecular” dibujado, no podría ser C–H–H–C? La respuesta reside en las características electrónicas propias de cada átomo.
Así, debido a que el hidrógeno tiene un solo electrón y un único orbital disponible para llenar, forma solamente un enlace covalente. Por lo tanto, jamás puede formar dos enlaces (no confundir con los puentes de hidrógeno). Por otro lado, la configuración electrónica del átomo de carbono le permite (y exige) la formación de cuatro enlaces covalentes.
Por esa razón las estructuras de Lewis donde intervienen C y H deben ser coherentes y respetar lo regido por sus configuraciones electrónicas. De esta manera, si el carbono tiene más de cuatro enlaces, o el hidrógeno más de uno, entonces puede descartarse el bosquejo y empezar uno nuevo más acorde a la realidad.
Es aquí donde aparecen unos de los principales motivos o respaldos de estas estructuras, introducidas por Gilbert Newton Lewis en su búsqueda de representaciones moleculares fieles a los datos experimentales: la estructura molecular y las cargas formales.
Todos los compuestos existentes pueden representarse por estructuras de Lewis, dando una primera aproximación a cómo podría ser la molécula o los iones.
TAREA
1, EN SU CUADERNO REALICE UN MAPA CONCEPTUAL DEL TEMA PLANTEADO
2. EN UNA HOJA PERFORADA REALICE DOS EJERCICIOS DE LA PAGINAS 199 DEL TEXTO,
3 RECUERSE SI NO ES NECESARIO SALIR. QUÉDESE ENCASA
No hay comentarios:
Publicar un comentario