Atomo de Carbono
Dentro de la tabla periódica de los elementos lo encontramos como el elemento químico C situado dentro de los No metales con un número atómico de valor 6 y una masa atómica de 12.011. Los átomos de carbono tienen 6 protones en el núcleo, 6 electrones que orbitan alrededor del núcleo y normalmente 6 neutrones.Otras características del átomo de carbono son:
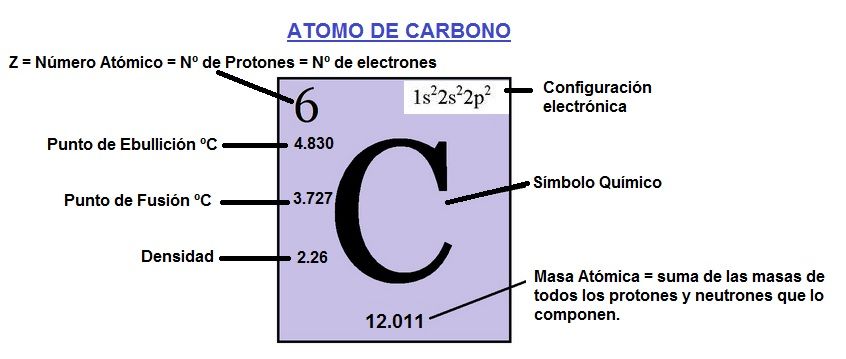
Punto de ebullición: 4.830ºC.
Punto de fusión: 3.727ºC.
Densidad: 2.267g/mL.
Estos datos más la configuración electrónica los puedes ver en la imagen de arriba. Algunos datos más sobre el átomo de carbono son:
Dureza escala de Mohs: 0,5
Valencia: 2,+4,-4
Estado de oxidación: +4
Electronegatividad: 2,5
Radio covalente (Å): 0,77
Radio iónico (Å): 0,15
Radio atómico (Å): 0,914
Estructura del Carbono
El átomo de carbono tiene 6 electrones, 4 de los electrones en su capa, órbita o banda de valencia (orbita más externa) y 2 en la capa más interna (más cercana al núcleo).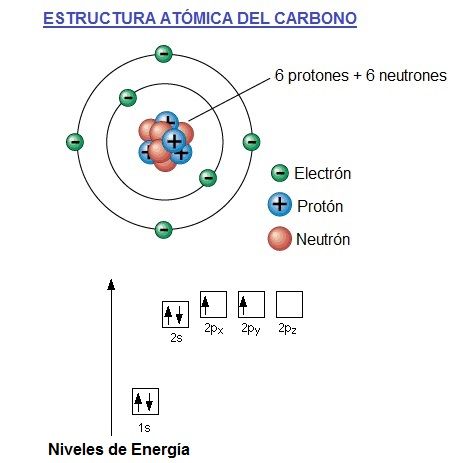
El dibujo de arriba es una simplificación del átomo de carbono y puede ser engañosa. Da la impresión de que los electrones circulan en torno al núcleo en órbitas similares a la Tierra alrededor del sol. En realidad, no es posible saber con exactitud dónde se encuentran los electrones. Además el átomo es una esfera (3 dimensiones).
Una manera mejor de mirar el átomo de carbono es mediante el uso de un gráfico de niveles de energía, también llamados orbitales de energía, que se muestra en la parte de abajo. Vemos que el carbono tiene seis electrones representados uno por cada flecha. Los cuadros representarían la órbita en la que están girando cada uno de ellos alrededor del núcleo. Los electrones del cuadro de abajo (1s) son los que tienen menos energía, ya que son los que están girando más cerca del núcleo del átomo de carbono.
La dirección de la flecha representa el espín electrónico. El espín es como la representación de la rotación del electrón sobre su eje, ya que no solo gira alrededor del núcleo, también lo hace sobre su propio eje como la tierra alrededor del sol, que gira alrededor de la tierra pero también sobre su propio eje.
Vamos a seguir explicando esto, pero antes fíjate en la siguiente imagen que representa mucho mejor el átomo de carbono:

Como ya deberíamos saber, sino lo sabes mira el siguiente enlace: Configuración Electrónica, los electrones del nivel de energía 1 están en el único subnivel de energía que tiene este nivel, que es el s, y que como admite como máximo 2 electrones, pues ahí estarán los 2 primeros, girando en ese órbita (representada por el cuadrado + arriba). Los electrones del nivel 1 son los que tienen menos energía, ya que están mas cerca del núcleo. Ahora pasamos al segundo nivel de energía, el nivel 2.
En el nivel 2, hay 2 subniveles de energía diferentes, el s y el p. En el s, que solo admite 2, estarán los 2 electrones siguientes, y en el p, que admite hasta 6, con 3 orbitas diferentes, estarán los otros dos que faltan (recuerda que son 6 en total en el carbono).
Los electrones en el subnivel s del nivel 2, tendrán un poco menos de energía que los del subnivel p aunque los dos estén en el mismo nivel de energía, en el 2. Los del p están girando un poco más separados del núcleo, por eso se representan un poco más arriba en la gráfica de niveles de energía.
Además si te fijas, los 2 electrones del subnivel p están girando cada uno en una órbita diferente y la otra órbita estará vacía. Esto es así por que los electrones prefieren estar girando en órbitas diferentes, si pueden, aunque tengan el mismo nivel de energía. Lógicamente si hubiera 4 electrones en el subnivel p, algunos tendrían que girar 2 en la misma órbita obligatoriamente, pero no es el caso del carbono. Con la siguiente imagen seguro que te queda mucho más claro el nivel p:

No hay comentarios:
Publicar un comentario