Reactivo limitante y reactivo en exceso
ACTIVIDAD DE REFLEXIÓN INICIAL:
Imaginemos que queremos hacer emparedados o sándwiches. Para un emparedado necesitamos 2 rebanadas de pan y 1 de jamón. Pensemos ahora que tenemos 20 rebanadas de pan y solamente 5 rebanadas de jamón.
a) ¿Cuántos emparedados podremos hacer?
|
b) ¿Por qué? Trata de hacer un análisis profundo y contesta argumentando.
|
c) ¿Cuál es el ingrediente que se termina primero?
|
d) ¿Cuál el ingrediente que tenemos en exceso?
|
A partir de la situación anterior, vamos a analizar dos conceptos muy importantes para el trabajo de un químico en situaciones reales que implican reacciones químicas.
a) El reactivo limitante es aquel del cual tenemos en menor cantidad y, por lo tanto, se terminará primero al momento de la reacción química, dando como resultado el final de la reacción, esto quiere decir que cuando se termine ya no se podrá seguir generando cierto producto. En el caso anterior, el reactivo limitante es el jamón, ya que al terminarse no se pueden seguir haciendo más emparedados
b) El reactivo en exceso es aquel del cual tenemos más de lo necesario para que se lleve a cabo la reacción química. En el caso de los emparedados, el reactivo en exceso son las rebanadas de pan, ya que sólo se utilizaron 10 rebanadas para los únicos 5 emparedados que se pudieron hacer.
Debido a la presencia del reactivo limitante, podemos decir que las reacciones van a estar “limitadas” por éste, por lo cual cuando vayamos a obtener la cantidad de cierto producto tenemos que partir del reactivo limitante para poder sacar la cantidad de producto correcta.
EJEMPLOS
1.- A altas temperaturas el azufre se combina con el hierro para formar el sulfato de hierro (II) café oscuro:
En un experimento 7.621 g de Fe se dejan reaccionar con 8.669 g de S.
a) ¿Cuál de los dos es el reactivo limitante?
Antes de cualquier otra cosa, es conveniente sacar las masas teóricas de los reactivos y del producto. Después de eso, procedemos a anotar las masas reales dadas.
Para proceder a conocer cuál es el reactivo limitante, vamos a evaluar los dos reactivos y ver cuál de los dos producen menos FeS, el cual será el reactivo limitante.
b) Calcula la masa de FeS formada.
La ventaja de utilizar el método anterior, es que ya nos da la masa directamente del FeS.
Respuesta: 11.988 g= 12 g de FeS.
c) ¿Qué cantidad del reactivo excedente (en g) queda al final de la reacción?
Sabemos por el procedimiento anterior que el reactivo en exceso es el azufre. Por lo cual, necesitamos evaluar la cantidad de azufre que necesita para reaccionar nuestra cantidad de hierro inicial:
TAREA
1. Conteste las preguntas de la parte de arriba
2 Resuelve el siguiente problema.
3 Por favor enviar al correo dperalta.tareas.ocp@gmail.com el otro correo no sirve.
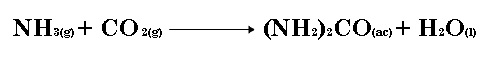
La UREA [(NH2)2CO] se usa como fertilizante, como alimento para animales y en la industria de los polímeros. Se prepara por reacción del amoniaco con el dióxido de carbono:
En cierto proceso, se hacen reaccionar 637.3 g de NH3 con 1141 g de CO2. a) ¿Cuál de los dos reactivos es el limitante? |


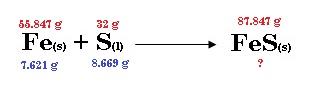


No hay comentarios:
Publicar un comentario