Estequiometría
En química, la estequiometría (del griego στοιχειον, stoikheion, 'elemento' y μετρον, métrón, 'medida') es el cálculo de las relaciones cuantitativas entre los reactivos y productos en el transcurso de una reacción química.1
Estas relaciones se pueden deducir a partir de la teoría atómica, aunque históricamente no se enunciaron sin hacer referencia a la composición de la materia, según distintas leyes y principios.
El primero que enunció los principios de la estequiometría fue Jeremias Benjamin Richter (1762-1807), en 1792, quien describió la estequiometría de la siguiente manera:
«La estequiometría es la ciencia que mide las proporciones cuantitativas o relaciones de masa de los elementos químicos que están implicados (en una reacción química)».
También estudia la proporción de los distintos elementos en un compuesto químico y la composición de mezclas químicas.
Algunos ejemplos son :
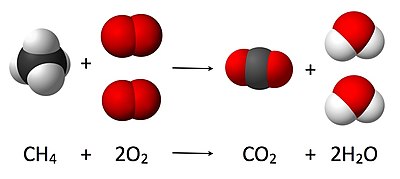
2g de H²,reaccionan con 32g de O² para dar 18g de H²O
2 moles de H²,reaccionan con 1 mol de O² para dar 2 moles de H²O
4g de H²,reaccionan con 22.41 en O² en CN para dar 18g de H²O.
TAREA
EN LA PAGINA 38 DE TEXTO HAY TRES EJERCICIOS A REALIZAR. ESCOJA UNO Y REALICE SIGUIENDO TODOS LOS PASOS
No hay comentarios:
Publicar un comentario