Número atómico, masa atómica y masa atómica relativa
Los átomos de cada elemento tienen un número característico de protones. De hecho, este determina qué átomo estamos viendo (por ejemplo, todos los átomos con 6 protones son átomos de carbono); el número de protones de un átomo se denomina número atómico. En cambio, el número de neutrones de un elemento dado puede variar. Las formas del mismo átomo que difieren solo en el número de neutrones se llaman isótopos. En conjunto, el número de protones y de neutrones determinan el número de masa de un elemento (número de masa = protones + neutrones). Si quieres calcular cuántos neutrones tiene un átomo, solo tienes que restar el número de protones, o número atómico, del número de masa.
Una propiedad estrechamente relacionada con el número de masa de un átomo es su masa atómica. La masa atómica de un átomo individual es simplemente su masa total y generalmente se expresa en unidades de masa atómica (uma). Por definición, un átomo de carbono con seis neutrones (carbono-12) tiene una masa atómica de 12 uma. Por razones que van más allá de lo que abarca este artículo, otros tipos de átomos generalmente no tienen masas atómicas en números enteros. Sin embargo, la masa atómica de un átomo en general será muy cercana a su número de masa aunque tendrá algunas diferencias en los decimales.
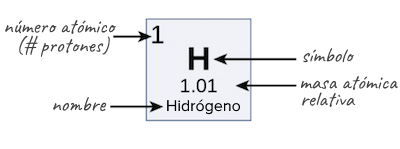
Debido a que los isótopos de un elemento tienen diferentes masas atómicas, los científicos también pueden determinar la masa atómica relativa (denominada algunas veces peso atómico) de un elemento. La masa atómica relativa es un promedio de las masas atómicas de los diferentes isótopos en una muestra y la contribución de cada isótopo al promedio se determina por medio de la cantidad que representa dentro de la muestra. Las masas atómicas relativas que aparecen en la tabla periódica (como la del hidrógeno, que se muestra a continuación) se calculan en todos los isótopos naturales de cada elemento, los cuales se ponderan con base en su abundancia en la Tierra. Los objetos extraterrestres, como los asteroides o meteoritos, pueden tener abundancias de isótopos muy distintas.
TAREA
REALIZAR DIEZ EJEMPLOS COMO LOS QUE REALIZAMOS EN CLASE Y PONER EL NÚMERO DE PROTONES, ELECTRONES Y NEUTRONES
ENVIAR A ESTE CORREO dperalta.tareas.ocp@gmail.com ya que el otro correo no esta bien. Saludos y un buen día
No hay comentarios:
Publicar un comentario