La propuesta de Schrodinger , considerado como el 5° modelo atómico, radica en describir las características de todos los electrones de un átomo, y para ello uso lo que conocemos como números cuánticos.
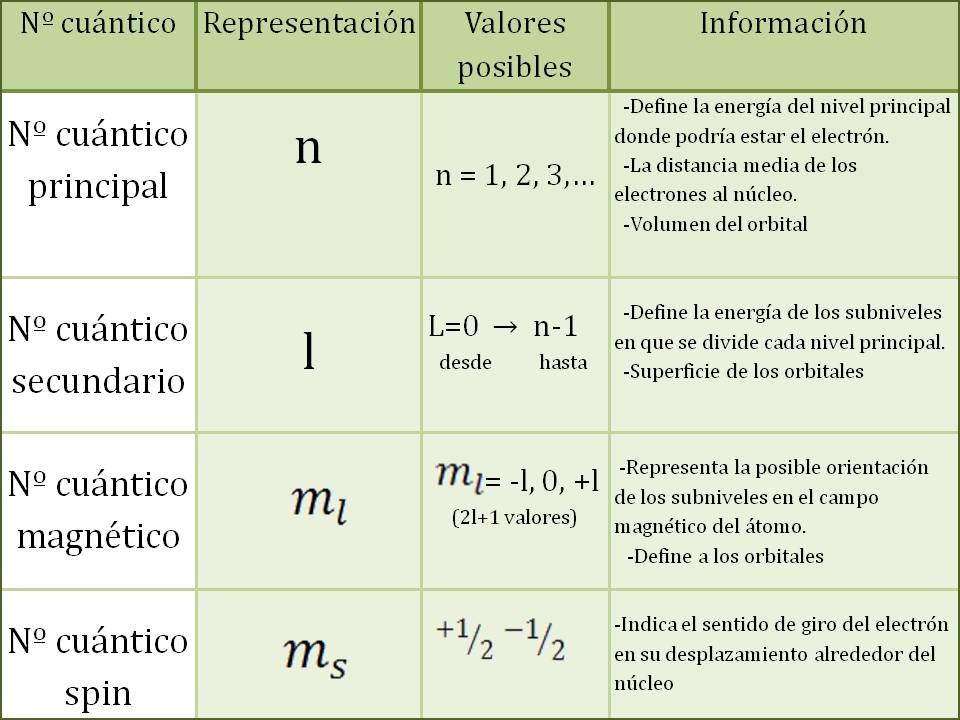
Los números cuánticos se denominan con las letras n, m, l y s y nos indican la posición y la energía del electrón. Ningún electrón de un mismo átomo puede tener los mismos números cuánticos.
El significado de los números cuánticos es:
n = número cuántico principal, que indica el nivel de energía donde se encuentra el electrón, asume valores enteros positivos, del 1 al 7.
l = número cuántico secundario, que indica el orbital en el que se encuentra el electrón, puede ser s, p, d y f (0, 1, 2 y 3).
m = número cuántico magnético, representa la orientación de los orbitales en el espacio, o el tipo de orbital, dentro de un orbital especifico. Asume valores del número cuántico secundario negativo (-l) pasando por cero, hasta el número cuántico positivo (+l).
s = número cuántico de spin, que describe la orientación del giro del electrón. Este número tiene en cuenta la rotación del electrón alrededor de su propio eje a medida que se mueve rodeando al núcleo. Asume únicamente dos valores +1/2 y -
En resumen los números cuánticos se expresan:
N: Nivel de energía (1, 2, 3, 4, 5, 6, 7)
L: Orbital (s=0, p=1, d=2 y f=3) del =0 (orbital s) hasta n - 1.
m: magnético (m=-l ,0 +1) desde -l, pasando por cero, hasta +l.
s: spin (-1, + 1).
Los números cuánticos sirven a su vez para entender la información que aporta la configuración electrónica
De esta forma se pueden obtener los números cuánticos de los electrones de los niveles superiores. Para mayor facilidad se presentará una tabla para asignar los números cuánticos correctos, conociendo la configuración electrónica y la localización exacta del electrón.
1s2-2s2-2p6-3s2-3p6-4s2-3d10-4p6-5s2-4d10-5p6-6s2-4f14-5d10-6p6-7s2-5f14-6d10-7p6
El número que precede al orbital es igual al número cuántico principal, por ejemplo para los electrones que están en el orbital 4p, el nivel = 4.
El número cuántico secundario se establece observando el orbital referido, por ejemplo para el orbital 4p, el subnivel es el orbital, l = 1 (p)
Los números cuánticos se denominan con las letras n, m, l y s y nos indican la posición y la energía del electrón. Ningún electrón de un mismo átomo puede tener los mismos números cuánticos.
El significado de los números cuánticos es:
n = número cuántico principal, que indica el nivel de energía donde se encuentra el electrón, asume valores enteros positivos, del 1 al 7.
l = número cuántico secundario, que indica el orbital en el que se encuentra el electrón, puede ser s, p, d y f (0, 1, 2 y 3).
m = número cuántico magnético, representa la orientación de los orbitales en el espacio, o el tipo de orbital, dentro de un orbital especifico. Asume valores del número cuántico secundario negativo (-l) pasando por cero, hasta el número cuántico positivo (+l).
s = número cuántico de spin, que describe la orientación del giro del electrón. Este número tiene en cuenta la rotación del electrón alrededor de su propio eje a medida que se mueve rodeando al núcleo. Asume únicamente dos valores +1/2 y -
En resumen los números cuánticos se expresan:
N: Nivel de energía (1, 2, 3, 4, 5, 6, 7)
L: Orbital (s=0, p=1, d=2 y f=3) del =0 (orbital s) hasta n - 1.
m: magnético (m=-l ,0 +1) desde -l, pasando por cero, hasta +l.
s: spin (-1, + 1).
Los números cuánticos sirven a su vez para entender la información que aporta la configuración electrónica
De esta forma se pueden obtener los números cuánticos de los electrones de los niveles superiores. Para mayor facilidad se presentará una tabla para asignar los números cuánticos correctos, conociendo la configuración electrónica y la localización exacta del electrón.
1s2-2s2-2p6-3s2-3p6-4s2-3d10-4p6-5s2-4d10-5p6-6s2-4f14-5d10-6p6-7s2-5f14-6d10-7p6
El número que precede al orbital es igual al número cuántico principal, por ejemplo para los electrones que están en el orbital 4p, el nivel = 4.
El número cuántico secundario se establece observando el orbital referido, por ejemplo para el orbital 4p, el subnivel es el orbital, l = 1 (p)
Existen tres tipos de orbitales p (px, py y pz) por lo que se dice que hay tres espacios donde se acomodan dos electrones en cada uno, esos espacios o tipos de orbitales reciben el número cuántico magnético de -1, 0 y +1. Es decir para el orbital p existen 3 números cuánticos magnéticos.
Si nos referimos al cuarto nivel de energía, 4s23d104p6? , y se menciona al orbital 4p, el superíndice indica el total de electrones de ese orbital, si se sabe que el orbital p siempre tiene los números cuánticos m (-1, 0, +1), entonces se agrupan de dos en dos, es decir 2 electrones para cada número cuántico magnético.
De tal manera que dos electrones (los apareados) diferirán únicamente del número cuántico s o de spin, ya que uno tendrá s = - 1/2 y el otro s = + 1/2.
Si nos referimos al cuarto nivel de energía, 4s23d104p6? , y se menciona al orbital 4p, el superíndice indica el total de electrones de ese orbital, si se sabe que el orbital p siempre tiene los números cuánticos m (-1, 0, +1), entonces se agrupan de dos en dos, es decir 2 electrones para cada número cuántico magnético.
De tal manera que dos electrones (los apareados) diferirán únicamente del número cuántico s o de spin, ya que uno tendrá s = - 1/2 y el otro s = + 1/2.
CONFIGURACIÓN ELECTRÓNICA
La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Aunque el modelo de Scrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
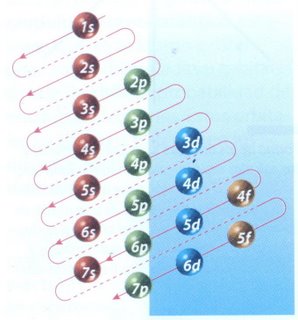
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal, para ello debes seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal, para ello debes seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta
Para escribir la configuración electrónica de un átomo es necesario:
Ejemplo:
Los orbitales se llenan en orden creciente de energía, con no más de dos electrones por orbital, según el principio de construcción de Aufbau.
Litio (Z = 3). Este elemento tiene 3 electrones. Empezaremos llenando el orbital de menor energía con dos electrones que tendrán distinto spin (ms). El electrón restante ocupará el orbital 2s, que es el siguiente con menor energía:
- Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).
- Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (n = 1).
- Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Ejemplo:
Los orbitales se llenan en orden creciente de energía, con no más de dos electrones por orbital, según el principio de construcción de Aufbau.
Litio (Z = 3). Este elemento tiene 3 electrones. Empezaremos llenando el orbital de menor energía con dos electrones que tendrán distinto spin (ms). El electrón restante ocupará el orbital 2s, que es el siguiente con menor energía:
TAREA
1. EN SU CUADERNO REALICE UN MAPA CONCEPTUAL DE ESTE TEMA
2. EN UNA HOJA PERFORADA REALICE LA DISTRIBUCIÓN ELECTRÓNICA DE LOS DIEZ PRIMEROS ELEMENTOS QUÍMICOS
No hay comentarios:
Publicar un comentario