Estructura de Lewis: en qué consiste, cómo se hace, ejemplos
Pero, ¿qué es un enlace covalente? Es la compartición de un par de electrones (o puntos) entre dos átomos cualquiera de la tabla periódica. Con estos diagramas se pueden bosquejar muchos esqueletos para un determinado compuesto. Cuál de ellos es el correcto dependerá de las cargas formales y de la naturaleza química de los mismos átomos.
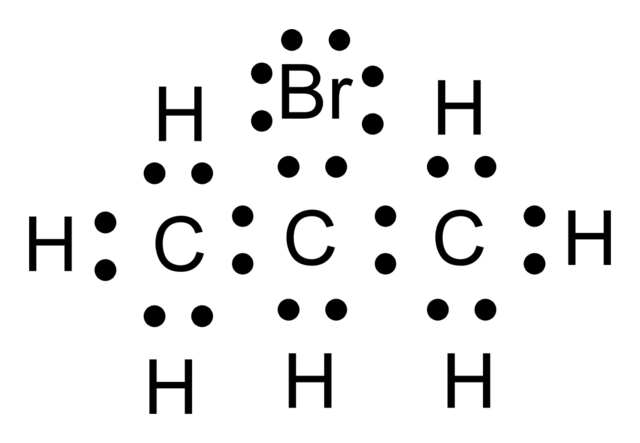
En la imagen superior se tiene un ejemplo de lo que es una estructura de Lewis. En este caso el compuesto representado es el 2-bromopropano. Pueden apreciarse los puntos negros correspondientes a los electrones, tanto los que participan en los enlaces como los no compartidos (el único par justo arriba del Br).
Si los pares de puntos “:” se sustituyeran por un guion largo “–“, entonces el esqueleto carbonado del 2-bromopropano se representaría como: C–C–C. ¿Por qué en lugar del “armazón molecular” dibujado, no podría ser C–H–H–C? La respuesta reside en las características electrónicas propias de cada átomo.
Así, debido a que el hidrógeno tiene un solo electrón y un único orbital disponible para llenar, forma solamente un enlace covalente. Por lo tanto, jamás puede formar dos enlaces (no confundir con los puentes de hidrógeno). Por otro lado, la configuración electrónica del átomo de carbono le permite (y exige) la formación de cuatro enlaces covalentes.
Por esa razón las estructuras de Lewis donde intervienen C y H deben ser coherentes y respetar lo regido por sus configuraciones electrónicas. De esta manera, si el carbono tiene más de cuatro enlaces, o el hidrógeno más de uno, entonces puede descartarse el bosquejo y empezar uno nuevo más acorde a la realidad.
Es aquí donde aparecen unos de los principales motivos o respaldos de estas estructuras, introducidas por Gilbert Newton Lewis en su búsqueda de representaciones moleculares fieles a los datos experimentales: la estructura molecular y las cargas formales.
Todos los compuestos existentes pueden representarse por estructuras de Lewis, dando una primera aproximación a cómo podría ser la molécula o los iones
¿Qué es la estructura de Lewis?
Es una estructura representativa de los electrones de valencia y los enlaces covalentes en una molécula o ion que sirve para tener una idea de su estructura molecular.
No obstante, esta estructura falla al predecir algunos detalles importantes como la geometría molecular respecto a un átomo y su entorno (si es cuadrada, plana trigonal, bipiramidal, etc.).
Asimismo, no dice nada respecto a cuál es la hibridación química de sus átomos, pero sí dónde se sitúan los dobles o triples enlaces y si existe resonancia en la estructura.
Con esta información puede argumentarse sobre la reactividad de un compuesto, su estabilidad, el cómo y qué mecanismo seguirá la molécula cuando reaccione.
Por esta razón las estructuras de Lewis nunca dejan de considerarse y son muy útiles, pues en ellas pueden condensarse los nuevos aprendizajes químicos.
¿Cómo se hace?
Para dibujar o bosquejar una estructura, fórmula o diagrama de Lewis es imprescindible la formula química del compuesto. Sin ella no se puede siquiera saber cuáles son los átomos que lo conforman. Una vez con ella se recurre a la tabla periódica para ubicar cuáles son los grupos a que pertenecen.
Por ejemplo, si se tiene el compuesto C14O2N3 entonces habría que buscar los grupos en donde está el carbono, el oxígeno y el nitrógeno. Hecho esto, sin importar cuál sea el compuesto, el número de electrones de valencia sigue siendo el mismo, por lo que tarde o temprano se memorizan.
Así, el carbono pertenece al grupo IVA, el oxígeno al grupo VIA y el nitrógeno al VA. El número de grupo es igual a la cantidad de electrones (puntos) de valencia. Todos ellos tienen en común la tendencia de completar el octeto de la capa de valencia.
¿Qué es la regla del octeto?
Esta dice que existe una tendencia de los átomos de completar su nivel energético con ocho electrones para alcanzar la estabilidad. Esto aplica para todos los elementos no metálicos o los que se encuentran en los bloques s o p de la tabla periódica.
No obstante, no todos los elementos obedecen la regla del octeto. Casos particulares son los metales de transición, cuyas estructuras se fundamentan más en las cargas formales y su número de grupo.
Aplicando la fórmula matemática
Conociendo a qué grupo pertenecen los elementos, y por tanto, el número de electrones de valencia disponibles para formar enlaces, se procede con la siguiente fórmula, la cual resulta útil para dibujar las estructuras de Lewis:
C = N – D
Donde C significa electrones compartidos, es decir, aquellos que participan en los enlaces covalentes. Como cada enlace lo conforman dos electrones, entonces C/2 es igual al número de enlaces (o guiones) que deben dibujarse.
N son los electrones necesarios, los que debe tener el átomo en su capa de valencia para ser isoelectrónico al gas noble que le sigue en el mismo período. Para todos los elementos distintos del H (ya que requiere de dos electrones para compararse al He) necesitan de ocho electrones.
D son los electrones disponibles, los cuales vienen determinados por el grupo o los números de electrones de valencia. Así, como el Cl pertenece al grupo VIIA, debe rodearse de siete puntos negros o electrones, y tener en mente que se necesitan un par para formar un enlace.
Teniendo los átomos, sus puntos y el número de enlaces C/2, puede entonces improvisarse una estructura de Lewis. Pero adicionalmente, es necesario tener noción de otras “reglas”.
Dónde colocar los átomos menos electronegativos
Los átomos menos electronegativos en la gran mayoría de las estructuras ocupan los centros. Por esta razón, si se tiene un compuesto con átomos de P, O y F, el P debe por lo tanto situarse en el centro de la hipotética estructura.
Asimismo, es importante resaltar que los hidrógenos normalmente se enlazan a los átomos muy electronegativos. Si se tiene en un compuesto Zn, H y O, el H irá junto al O y no con el Zn (Zn–O–H y no H–Zn–O). Hay excepciones a esta regla, pero ocurre por lo general con átomos no metálicos.
Simetría y las cargas formales
La naturaleza tiene una alta preferencia por originar estructuras moleculares lo más simétricas posibles. Esto ayuda a evitar plantear estructuras desordenadas, con los átomos dispuestos de tal manera que no obedecen ningún patrón aparenteor ejemplo, para el compuesto C2A3, donde A es un átomo ficticio, la estructura más probable sería A–C–A–C–A. Nótese la simetría de sus lados, ambos reflejos del otro.
Las cargas formales también juegan un papel importante al momento de dibujar las estructuras de Lewis, sobre todo para la de los iones. Así, se pueden agregar o quitar enlaces de forma que la carga formal de un átomo corresponda a la carga total exhibida. Este criterio es de mucha ayuda para los compuestos de los metales de transición.
Limitaciones en la regla del octeto
No todas las reglas se cumplen, lo que no necesariamente significa que la estructura sea incorrecta. Ejemplos típicos de esto se observan en muchos compuestos donde intervienen elementos del grupo IIIA (B, Al, Ga, In, Tl). Aquí se considera específicamente el trifluoruro de aluminio (AlF3).
Aplicando entonces la fórmula descrita anteriormente, se tiene:
D= 1×3 (un átomo de aluminio) + 7×3 (tres átomos de flúor) = 24 electrones
Aquí el 3 y el 7 son los respectivos grupos o números de electrones de valencia disponibles para el aluminio y el flúor. Luego, considerando los electrones necesarios N:
N= 8×1 (un átomo de aluminio) + 8×3 (tres átomos de flúor) = 32 electrones
Y por lo tanto los electrones compartidos son:
C= N – D
C= 32 – 24 = 8 electrones
C/2 = 4 enlaces
Dado que el aluminio es el átomo menos electronegativo, debe colocarse en el centro, y el flúor solo forma un enlace. Considerando esto se tiene la estructura de Lewis del AlF3 (imagen superior). Los electrones compartidos están resaltados con puntos verdes para distinguirlos de los no compartidos.
Aunque los cálculos predicen que son 4 enlaces los que deben formarse, el aluminio carece de electrones suficientes y además no hay un cuarto átomo de flúor. Como resultado el aluminio no cumple con la regla del octeto y este hecho no se refleja en los cálculos.
Ejemplos de estructuras de Lewis
Yodo
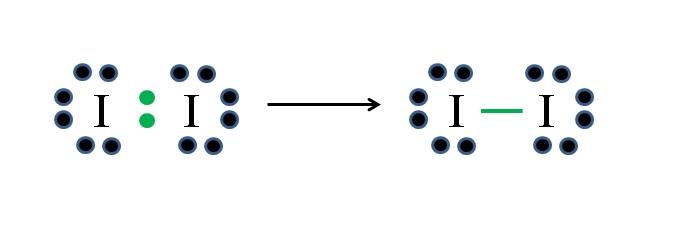
El yodo es un halógeno y por tanto pertenece al grupo VIIA. Tiene entonces siete electrones de valencia, y esta simple molécula diatómica puede representarse improvisando o aplicando la fórmula:
D= 2×7 (dos átomos de yodo) = 14 electrones
N= 2×8 = 16 electrones
C = 16 – 14 = 2 electrones
C/2 = 1 enlace
Como de 14 electrones 2 participan en el enlace covalente (puntos y guion verdes), 12 permanecen como no compartidos; y debido a que son dos átomos de yodo, 6 deben repartirse para uno de ellos (sus electrones de valencia). En esta molécula solo es posible esta estructura, cuya geometría es lineal.
Amoníaco
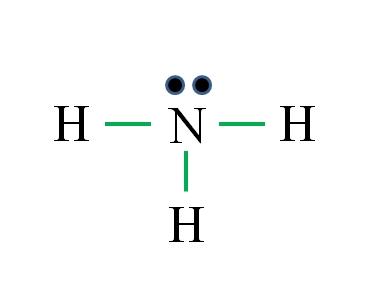
¿Cuál es la estructura de Lewis para la molécula de amoníaco? Como el nitrógeno es del grupo VA tiene cinco electrones de valencia, y entonces:
D = 1×5 (un átomo de nitrógeno) + 1×3 (tres átomos de hidrógeno) = 8 electrones
N = 8×1 + 2×3 = 14 electrones
C = 14 – 8 = 6 electrones
C/2= 3 enlaces
Esta vez la fórmula acierta con el número de enlaces (tres enlaces verdes). Como de los 8 electrones disponibles 6 participan en los enlaces, queda un par no compartido que se ubica encima del átomo de nitrógeno.
Esta estructura dice todo lo que debe saberse de la base amoníaco. Aplicando los conocimientos de TEV y TRPEV, se deduce que la geometría es tetraédrica distorsionada por el par libre del nitrógeno y que la hibridación de éste es por consiguiente sp3.
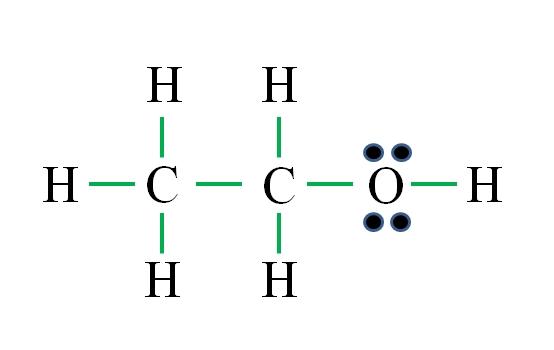
C2H6O
La fórmula corresponde a un compuesto orgánico. Antes de aplicar la fórmula debe recordarse que los hidrógenos forman un solo enlace, el oxígeno dos, el carbono cuatro y que la estructura debe ser lo más simétrica posible. Procediendo como los ejemplos anteriores se tiene:
D= 6×1 (seis átomos de hidrógeno) + 6×1 (un átomo de oxígeno) + 4×2 (dos átomos de carbono) = 20 electrones
N= 6×2 (seis átomos de hidrógeno) + 8×1 (un átomo de oxígeno) + 8×2 (dos átomos de carbono) = 36 electrones
C = 36 – 20 = 16 electrones
C/2 = 8 enlaces
El número de guiones verdes corresponden a los 8 enlaces calculados. La estructura de Lewis propuesta es la del etanol CH3CH2OH. Sin embargo, también hubiera sido correcto proponer la estructura del éter dimetílico CH3OCH3, la cual es aún más simétrica.
¿Cuál de las dos es “más” correcta? Ambas lo son por igual, ya que las estructuras surgieron como isómeros estructurales de una misma fórmula molecular C2H6O.
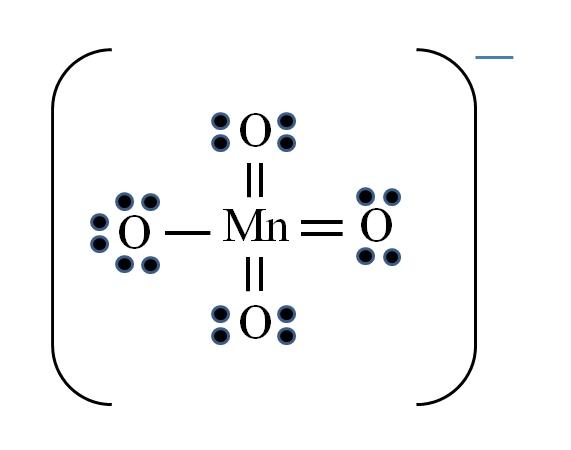
Ion permanganato
La situación se complica cuando se desea hacer las estructuras de Lewis para compuestos de metales de transición. El manganeso pertenece al grupo VIIB, asimismo, el electrón de la carga negativa debe sumarse entre los electrones disponibles. Aplicando la fórmula se tiene:
D = 7×1 (un átomo de manganeso) + 6×4 (cuatro átomos de oxígeno) + 1 electrón por la carga = 32 electrones
N = 8×1 + 8×4 = 40 electrones
C = 40 – 32 = 8 electrones compartidos
C/2 = 4 enlaces
Sin embargo, los metales de transición pueden tener más de ocho electrones de valencia. Además, para que el ion MnO4– exhiba la carga negativa es necesario disminuir las cargas formales de los átomos de oxígeno. ¿Cómo? A través de los dobles enlaces.
Si todos los enlaces del MnO4– fueran simples, las cargas formales de los oxígenos serían iguales a -1. Como son cuatro, la carga resultante sería -4 para el anión, lo cual evidentemente no es cierto. Al formarse los dobles enlaces se garantiza que un solo oxígeno tenga carga formal negativa, reflejada en el ion.
En el ion permanganato puede apreciarse que existe resonancia. Ésta implica que el único enlace simple Mn–O se deslocaliza entre los cuatro átomos de O.
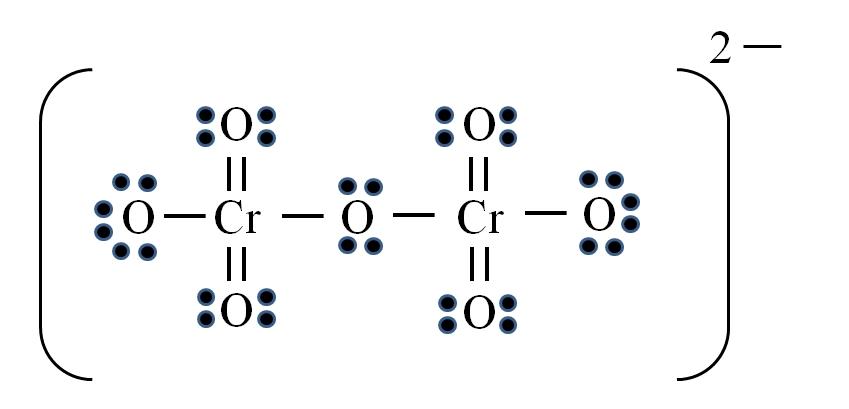
Ion dicromato
Finalmente, un caso similar ocurre con el ion dicromato (Cr2O7). El cromo pertenece al grupo VIB, por lo que tiene seis electrones de valencia. Aplicando nuevamente la fórmula:
D = 6×2 (dos átomos de cromo) + 6×7 (siete átomos de oxígeno) + 2 electrones por la carga divalente= 56 electrones
N= 8×2 + 8×7= 72 electrones
C = 72 – 56 = 16 electrones compartidos
C/2= 8 enlaces
Pero no hay 8 enlaces, sino 12. Por las mismas razones encontradas, en el ion permanganato deben dejarse dos oxígenos con cargas formales negativas que sumen igual a -2, la carga del ion dicromato.
Así, se agregan tantos dobles enlaces como sean necesarios. De esta manera se llega a la estructura de Lewis de la imagen para el Cr2O72–.
TAREA
1. EN UNA HOJA PERFORADA REALICE DIEZ EJEMPLOS DE LA COMBINACIÓN DE UN METAL CON UN NO METAL EN LA ESTRUCTUTA DE LEWIS
2.Realicen las representaciones de Lewis en su ccuaderno de los siguientes elementos:
zinc, francio, helio, bario y aluminio.
2. Grafiquen la estructura de Lewis del óxido de dicloro (Cl2O).

No hay comentarios:
Publicar un comentario