Ejemplos de estructuras de Lewis
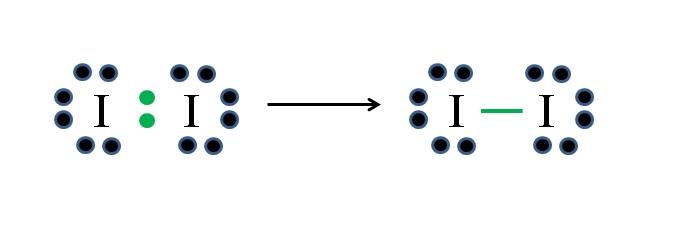
Yodo
El yodo es un halógeno y por tanto pertenece al grupo VIIA. Tiene entonces siete electrones de valencia, y esta simple molécula diatómica puede representarse improvisando o aplicando la fórmula:
D= 2×7 (dos átomos de yodo) = 14 electrones
N= 2×8 = 16 electrones
C = 16 – 14 = 2 electrones
C/2 = 1 enlace
Como de 14 electrones 2 participan en el enlace covalente (puntos y guion verdes), 12 permanecen como no compartidos; y debido a que son dos átomos de yodo, 6 deben repartirse para uno de ellos (sus electrones de valencia). En esta molécula solo es posible esta estructura, cuya geometría es lineal.
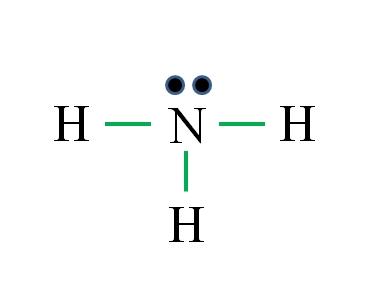
Amoníaco
¿Cuál es la estructura de Lewis para la molécula de amoníaco? Como el nitrógeno es del grupo VA tiene cinco electrones de valencia, y entonces:
D = 1×5 (un átomo de nitrógeno) + 1×3 (tres átomos de hidrógeno) = 8 electrones
N = 8×1 + 2×3 = 14 electrones
C = 14 – 8 = 6 electrones
C/2= 3 enlaces
Esta vez la fórmula acierta con el número de enlaces (tres enlaces verdes). Como de los 8 electrones disponibles 6 participan en los enlaces, queda un par no compartido que se ubica encima del átomo de nitrógeno.
Esta estructura dice todo lo que debe saberse de la base amoníaco. Aplicando los conocimientos de TEV y TRPEV, se deduce que la geometría es tetraédrica distorsionada por el par libre del nitrógeno y que la hibridación de éste es por consiguiente sp3.
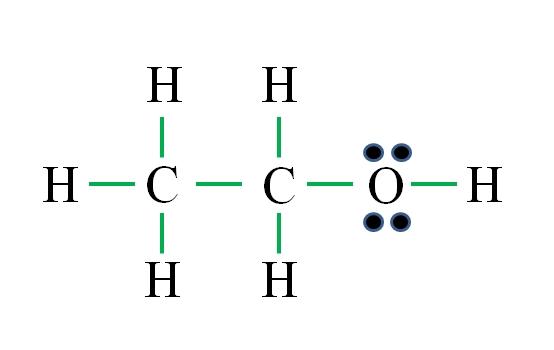
C2H6O
La fórmula corresponde a un compuesto orgánico. Antes de aplicar la fórmula debe recordarse que los hidrógenos forman un solo enlace, el oxígeno dos, el carbono cuatro y que la estructura debe ser lo más simétrica posible. Procediendo como los ejemplos anteriores se tiene:
D= 6×1 (seis átomos de hidrógeno) + 6×1 (un átomo de oxígeno) + 4×2 (dos átomos de carbono) = 20 electrones
N= 6×2 (seis átomos de hidrógeno) + 8×1 (un átomo de oxígeno) + 8×2 (dos átomos de carbono) = 36 electrones
C = 36 – 20 = 16 electrones
C/2 = 8 enlaces
El número de guiones verdes corresponden a los 8 enlaces calculados. La estructura de Lewis propuesta es la del etanol CH3CH2OH. Sin embargo, también hubiera sido correcto proponer la estructura del éter dimetílico CH3OCH3, la cual es aún más simétrica.
TAREA
1. EN UN HOJA PERFORADA ESCRIBA DOS ESTRUCTURAS DE LEWIS
No hay comentarios:
Publicar un comentario