Ley de Boyle-Mariotte
Bien, bien! Hoy hablaremos sobre la ley de Boyle-Mariotte, y como siempre no me pondré hablar mucha la teoría porque entiendo que como estudiante lo que más detestamos es enrollarnos mucho con ello, y preferimos siempre la forma práctica. Es por ello que en este post, haré mención de como podemos enfrentarnos con esta famosa ley.
Antes que nada quiero decirte y hacerte entender que Boyle y Mariotte son dos científicos distintos, uno Irlandés y el otro Francés respectivamente, lo que quiero es que no vayas a pensar que esto se trate de una sola persona. Así que sabiendo esto, y con respeto a estos dos grandes científicos daremos inicio a el desglose del tema.
Entendiendo la ley de Boyle Mariotte
El comportamiento de un gas va depender siempre de la relación que existan entre tres factores muy importantes, que son: el volumen, la presión y la temperatura. No obstante, estas relaciones fueron experimentadas por los científicos Boyle y Mariotte, de tal forma que dicho principio se generaliza como:Si la temperatura permanece constante, el volumen de una masa gaseosa es inversamente proporcional a la presión que se le aplica.Es muy probable que al leer el enunciado citado arriba, no lo entiendas del todo, y te doy la razón, está confuso en principio, pero aquí te diré que nos quiere dar a entender.
Vamos a establecer matemáticamente el enunciado.
Despejando, de tal forma que nos quede la unidad en el miembro derecho, tendremos algo así.
Introduciendo la constante de proporcionalidad, nos queda que:
Ahora, si queremos ver los cambios que experimentará un gas, comúnmente se hace en un estado inicial y final, por lo que la expresión matemática o fórmula de Boyle-Mariotte queda de la siguiente forma.
Dónde
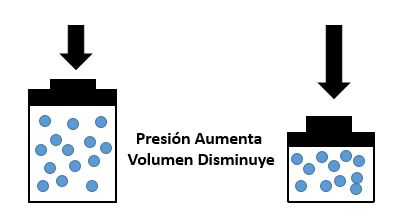
En pocas palabras la Ley de Boyle- Mariotte nos quiere dar a entender que si la presión aumenta, el volumen disminuye, y si la presión disminuye el volumen aumenta. Fácil ¿no?
EJERCICIOS PROPUESTOS
1.- Una muestra de oxígeno ocupa 4.2 litros a 760 mm de Hg. ¿Cuál será el volumen del oxígeno
a 415 mm de Hg, si la temperatura permanece
constante?
No hay comentarios:
Publicar un comentario