-
¿Qué es un enlace químico?
Los enlaces químicos ocurren en la naturaleza y forman parte tanto de sustancias inorgánicas como de formas de vida, ya que sin ellos no podrían construirse las proteínas y aminoácidos complejos que conforman nuestros cuerpos.
De manera semejante, los enlaces químicos pueden romperse bajo ciertas y determinadas condiciones, como al ser sometidos a cantidades de calor, a la acción de la electricidad, o a la de sustancias que rompan la unión existente y propicien otras nuevas junturas.
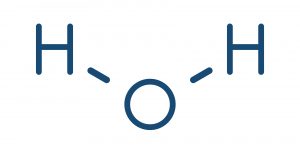
Así, por ejemplo, es posible someter al agua a electricidad para separar las uniones químicas entre el hidrógeno y el oxígeno que la conforman, en un proceso denominado electrólisis; o añadir grandes cantidades de energía calórica a una proteína para romper sus enlaces y desnaturalizarla, es decir, romperla en trozos más pequeños.
Ver también: Modelos Atómicos.
-
Tipos de enlace químico
- Enlace covalente. Ocurre entre átomos no metálicos y de cargas electromagnéticas semejantes (por lo general altas), que se juntan y comparten algunos pares de electrones de su última órbita (la más externa), y conseguir una forma eléctrica más estable. Es el tipo de enlace predominante en las moléculas orgánicas y puede ser de tres tipos: simple (A-A), doble (A=A) y triple (A≡A), dependiendo de la cantidad de electrones compartidos.
- Enlace iónico. Tiene lugar entre átomos metálicos y no metálicos, y consiste en una transferencia permanente de electrones desde el átomo metálico hacia el átomo no metálico, produciendo una molécula cargada eléctricamente en algún sentido, ya sea cationes (+1) o aniones (-1).
- Enlace metálico. Se da únicamente entre átomos metálicos de un mismo elemento, que por lo general constituyen estructuras sólidas, sumamente compactas. Es un enlace fuerte, que junta los núcleos atómicos entre sí, rodeados de sus electrones como en una nube, y cuesta mucho esfuerzo separarlos.
-
Ejemplos de enlace químico
- Benceno (C6H6)
- Metano (CH4)
- Glucosa (C6H12O6)
- Amoníaco (NH3)
- Freón (CFC)
- En todas las formas del carbono (C): carbón, diamantes, grafeno, etc.
- Óxido de magnesio (MgO)
- Sulfato de cobre (CuSO4)
- Ioduro de potasio (KI)
- Cloruro de manganeso (MnCl2)
- Carbonato de calcio (CaCO3)
- Sulfuro de hierro (Fe2S3)
- Barras de hierro (Fe)
- Yacimientos de cobre (Cu)
- Barras de oro puro (Au)
- Barras de plata pura (Ag)
Última edición: 11 de enero de 2019. Cómo citar: "Enlace químico". Autor: María Estela Raffino. De: Argentina. Para: Concepto.de. Disponible en: https://concepto.de/enlace-quimico/. Consultado: 02 de diciembre de 2019.






No hay comentarios:
Publicar un comentario