Estequiometría, moles y volumen de gases
Halla el volumen de cloro, medido a 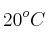 y 746 mm Hg, que se obtendrá al hacer reaccionar 50 g de permanganato
de potasio con exceso de ácido clorhídrico, según la reacción:
y 746 mm Hg, que se obtendrá al hacer reaccionar 50 g de permanganato
de potasio con exceso de ácido clorhídrico, según la reacción:
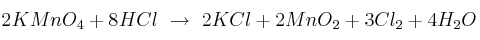
Resuelva un ejercicio
- La reacción entre el cinc y el ácido clorhídrico produce cloruro de cinc e hidrógeno. para determinar la riqueza de un cinc muy impuro se tomaron 5g de muestra y se hicieron reaccionar con ácido clorhídrico en exceso.El volumen de hidrógeno producido fue de 824cm3,¿que porcentaje de cinc hay en la muestra?
-
Un recipiente de 1l contiene hidrógeno gaseoso a 326torr y 168 grados y oxigeno gaseoso a 652 torr y 168 grados. Se hace saltar una chispa en el seno de la mezcla a fin de que se produzca la reacción 2H2 + O2-----2H2O cual será la presión final en el recipiente si la temperatura final es 197 grados?.
-
-
-