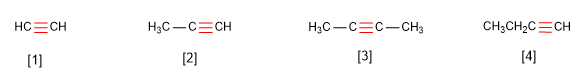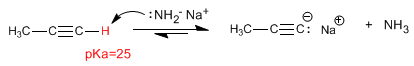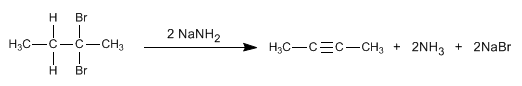Mitosis
La mitosis es el proceso mediante el cual una célula eucariota separa los cromosomas en su núcleo, dando como resultado dos juegos idénticos. Éstos se llaman “células hijas”.
La mitosis es una forma de reproducción asexual. Esta permite que un organismo pueda clonar copias exactas de la célula original. Este método de reproducción es rápido y eficaz, sin embargo, no da a lugar para la diversidad; ya que todos los productos son idénticos a la célula de la cual se originan.
Meiosis
La meiosis, por otra parte, es un tipo de reproducción sexual. Es un tipo especial de división celular necesaria para la reproducción sexual en las eucariotas.Las células resultantes de la meiosis son gametos o esporas. Los gametos son el esperma y los óvulos en la mayoría de los organismos (son las células sexuales), comunes tanto en animales como en plantas.


Diferencias clave entre meiosis y mitosis
- La mitosis es asexual, mientras que la meiosis es sexual.
- En la mitosis, la célula madre se divide en dos; mientras que en la meiosis se divide en cuatro.
- En la meiosis, las células hijas sólo poseen la mitad de los cromosomas de las células originales; mientras que en la mitosis la cantidad de cromosomas es igual tanto en las células madres como en las hijas.
- La mitosis se lleva a cabo en todos los organismos con células eucariotas, mientras que la meiosis sólo ocurre en organismos cuya reproducción es sexual (es decir, que necesitan de ambos progenitores).


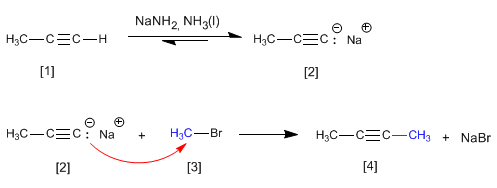
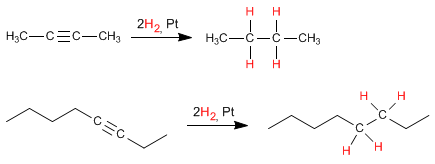
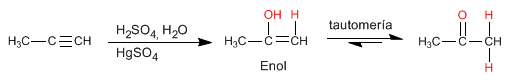
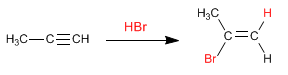
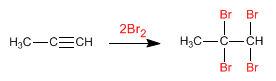
 Los
alquinos son hidrocarburos que contienen enlaces triples
carbono-carbono. La fórmula molecular general para alquinos acíclicos es
CnH2n-2 y su grado de insaturación es dos. El acetileno o etino es el alquino más simple, fue descubierto por Berthelot en 1862.
Los
alquinos son hidrocarburos que contienen enlaces triples
carbono-carbono. La fórmula molecular general para alquinos acíclicos es
CnH2n-2 y su grado de insaturación es dos. El acetileno o etino es el alquino más simple, fue descubierto por Berthelot en 1862.