De la alquimia a la química
Por ahí del año de 1660 nació un alquimista y médico alemán cuyo nombre George Ernst Stahl sería el detonante (o por lo menos uno de los más relevantes) en abrir a la comunidad científica uno de los problemas más complicados e interesantes a resolver: la constitución de la materia.
Como todo científico meticuloso es necesario puntualizar la importancia de plantear una buena hipótesis para después, analizar con cuidado nuestro supuesto y ponerlo a juicio de otros científicos quienes se encargarán de refutar nuestro planteamiento o bien, complementarlo.
Stahl (como buen alquimista) suponía que la combustión era un proceso que se explicaba por la presencia de alguna fuerza externa o material inflamable a la cual denomino flogisto el cual, se liberaba cuando la materia se quemaba.
Por supuesto que no paso mucho tiempo cuando Antoine Laurent Lavoisier refutó dicha teoría demostrando que la materia se conserva en una reacción química, es decir, que no se genera la combustión de forma espontánea sino que, existen elementos (reactivos) que al combinarse reaccionan obteniendo productos.
Además de Lavoisier, existieron otros personajes que aportaron sus propias leyes (Leyes ponderales) para explicar este fenómeno complejo de las reacciones químicas donde se ven involucrados las masas de los elementos. Dichos aportadores fueron: Dalton, Proust, además de Richter-Wenzel.
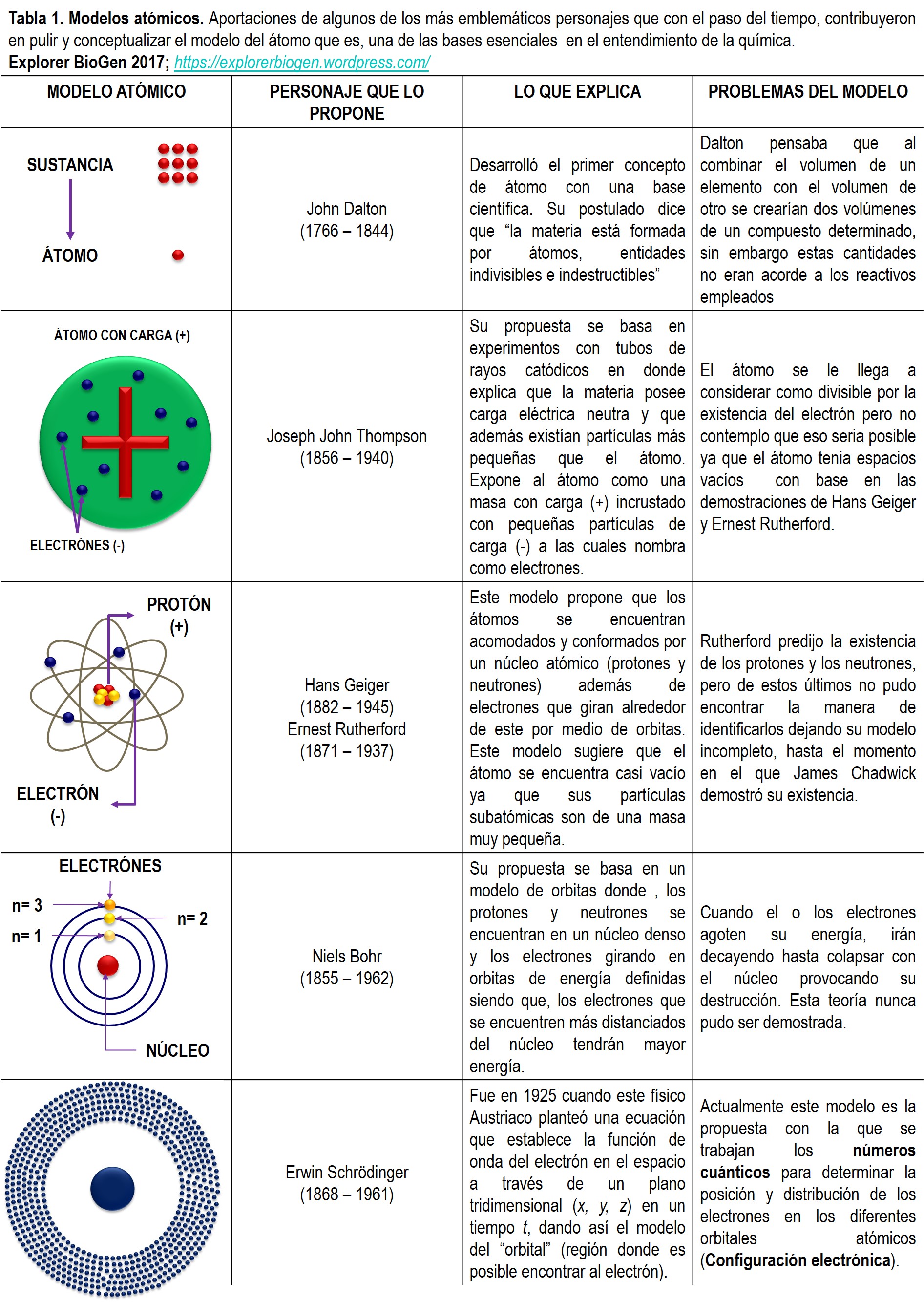
Casi a la par de estas aportaciones se fueron construyendo los modelos que ayudarían a explicar la constitución y el comportamiento de los átomos en los compuestos. A continuación se presenta un cuadro donde se exponen los diferentes modelos atómicos y sus cambios a través del tiempo.
El último modelo propuesto por Erwin Schrödinger explica cómo se distribuyen los electrones de un átomo determinado a través de sus orbitales (niveles energéticos) en un espacio de tres dimensiones. He de aclarar que como tal no existe un modelo esquemático que explique el planteamiento de Schrödinger ¿Por qué? Se explica teóricamente que un elemento cuenta con un determinado número de electrones “acomodados” en niveles energéticos, sin embargo en la constitución espacial los electrones no se pueden definir en un lugar fijo ya que estos se encuentran dispersos alrededor del núcleo atómico moviéndose constantemente en una “nube de electrones”. Es por eso que se le define a este concepto como una función de onda (Ψ2), es decir, la probabilidad de encontrar a un electrón en una región del espacio alrededor de su núcleo atómico.
Las partículas subatómicas
Una vez definida la forma actual del átomo, podemos decir que partículas subatómicas conforman a un átomo típico: primero empezamos con el núcleo atómico donde se encuentran los neutrones con carga neta de 0 o bien, carga neutra (+/-) y, los protones con carga positiva (+) por último, en los orbitales podemos encontrar a los electrones que se encuentran en constante movimiento y cuya carga es negativa (-).
A la cantidad de protones presentes en el núcleo de un átomo se le denomina como número atómico (Z) y es este el que define la identidad de cada elemento presente en la tabla periódica. El número de masa (A) hacen alusión a la suma de los protones y neutrones del núcleo.
Contamos también con la masa atómica que es el valor calculado en función del de la masa del isótopo carbono 12.
La configuración electrónica
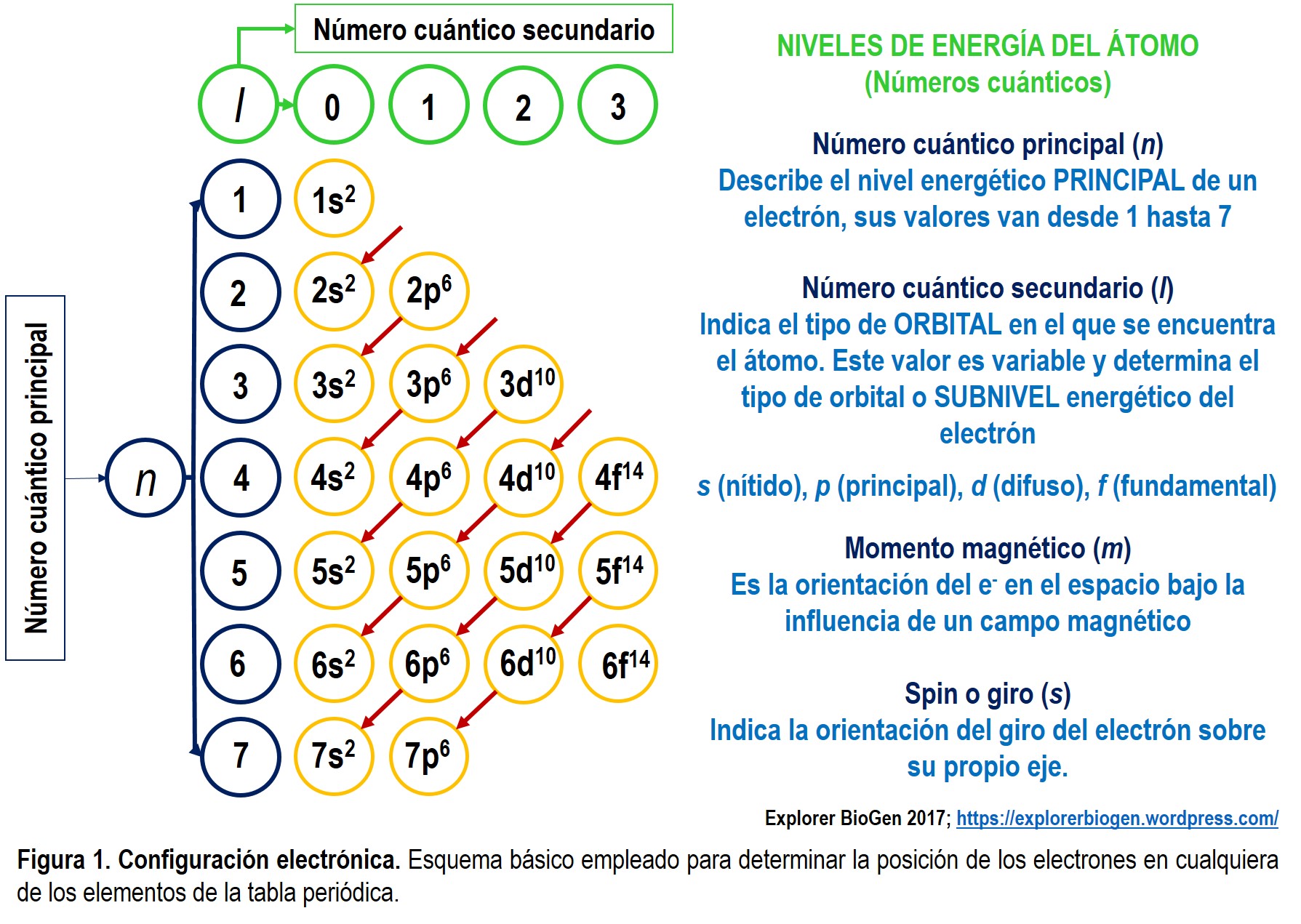
Esta consiste en la distribución de los electrones en diferentes orbitales atómicos. Para poder determinar en que nivel energético y en que posición se encuentra un electrón, esto es, definir su número cuántico es necesario contar con el dato del número atómico del elemento en cuestión (Fig. 1).
El número cuántico principal (n) describe siete niveles energéticos principales de los electrones.
El número cuántico secundario (I) hace referencia al sub-nivel energético en el que se encuentra posicionado el electrón:
Subnivel “s“ o subnivel 0 cuenta con 1 orbital con capacidad para 2 electrones.
Subnivel “p“ o subnivel 1 cuenta con 3 orbitales, cada una con capacidad de 2 electrones, dando un total posible de 6 electrones en este subnivel.
Subnivel “d“ o subnivel 2 cuenta con 5 orbitales, cada una con capacidad de 2 electrones, dando un total posible de 10 electrones en este subnivel.
Subnivel “f“ o subnivel 3 cuenta con 7 orbitales, cada una con capacidad de 2 electrones, dando un total posible de 14 electrones en este subnivel.
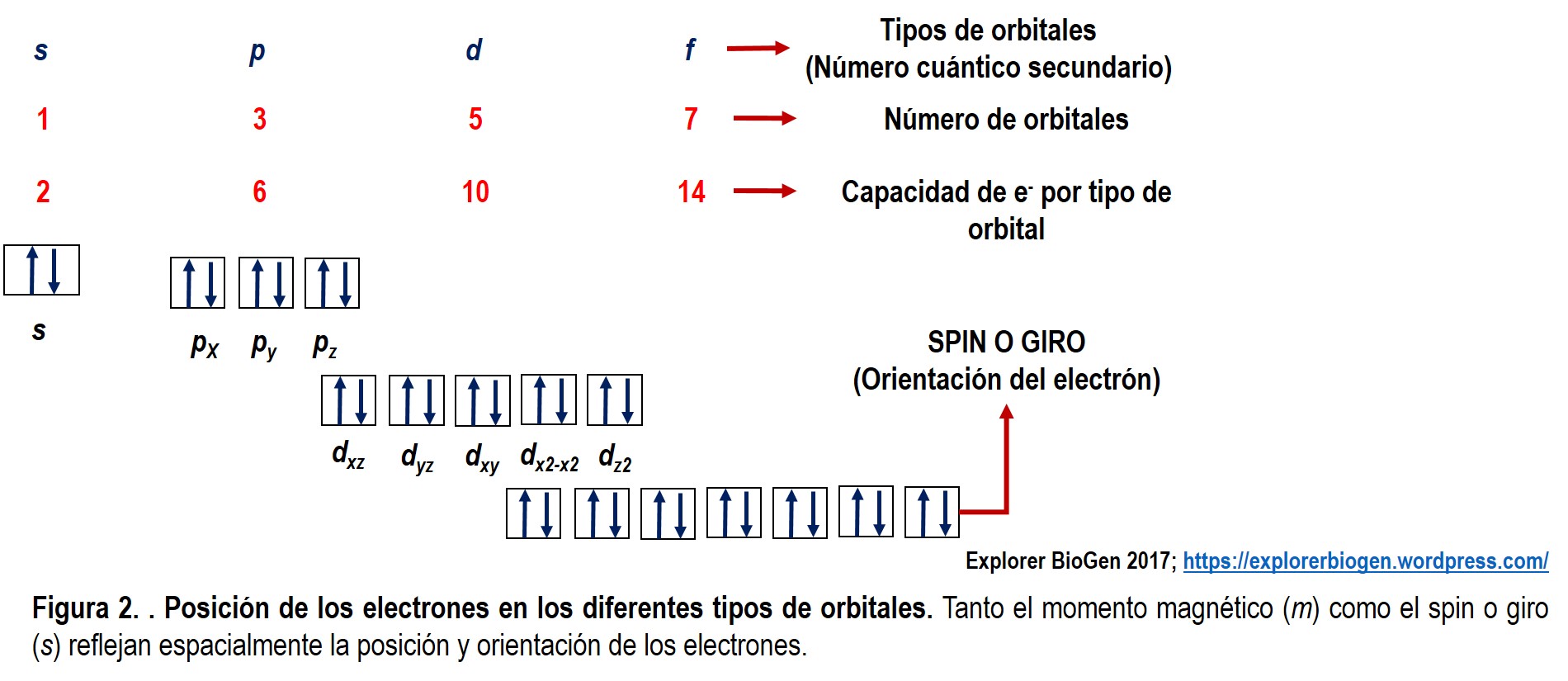
Tanto el momento magnético (m) como el spin o giro (s) se pueden entender como un arreglo o acomodo en una región espacial acorde al nivel energético del elemento que se esté interpretando (Fig. 2).
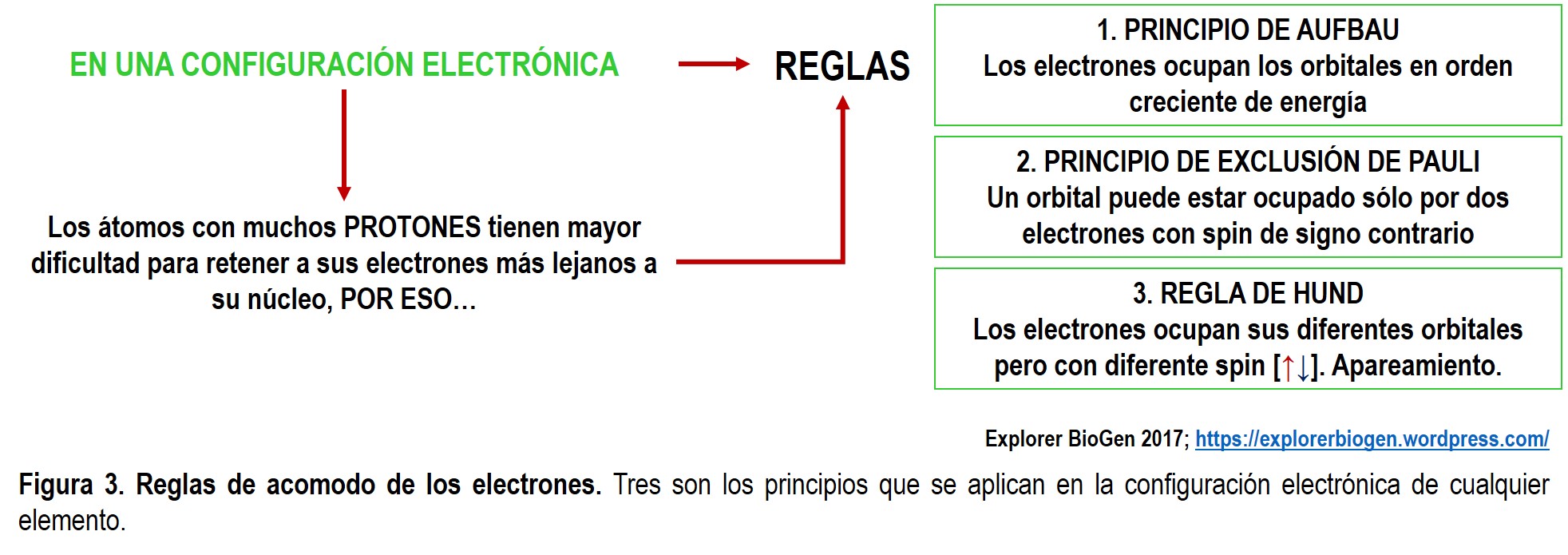
Es importante tener en cuenta tres principios básicos que nos ayudarán a darle un acomodo específico a los electrónes de cada elemento al momento de realizar una configuración electrónica (Fig. 3).
TAREA
REALICE CINCO PREGUNTAS DE SU TEXTO DE LAS PAGINAS 40 Y 41
No hay comentarios:
Publicar un comentario