Ley de conservación de la materia
La ley de conservación de la materia, conocida también como ley de conservación de la masa o simplemente como ley Lomonósov-Lavoisier (en honor a los científicos que la postularon), es un principio de la química que plantea que la materia no se crea ni se destruye durante una reacción química, solo se transforma.
Esto significa que las cantidades de las masas involucradas en una reacción determinada deberán ser constantes, es decir, la cantidad de reactivos consumidos es igual a la cantidad de productos formados, aunque se hayan transformado los unos en los otros.
Este principio fundamental de las ciencias naturales fue postulado por dos científicos de manera simultánea e independiente: el ruso Mijaíl Lomonósov en 1748 y el francés Antoine Lavoisier en 1785. Llama la atención que esto ocurriera antes del descubrimiento del átomo y la postulación de la teoría atómica, con la cual es mucho más sencillo explicar e ilustrar el fenómeno.
La excepción a la regla la constituyen las reacciones nucleares, en las que es posible convertir masa en energía y viceversa.
Junto a la equivalencia entre masa y energía, la ley de la conservación de la materia fue clave para la comprensión de la química contemporánea.
Ver además: Reacción exotérmica
Antecedentes de la Ley de conservación de la materia
La química de aquellos años entendía los procesos de reacción de manera muy distinta a la actual, en algunos casos llegando a afirmar lo contrario a lo que plantea esta ley.
En el siglo XVII Robert Boyle experimentaba al pesar metales antes y después de dejarlos oxidar. Este científico atribuía el cambio en el peso de estos metales a la ganancia de materia, ignorando que el óxido metálico que se formaba provenía de la reacción del metal con el oxígeno del aire.
Descubrimiento de la Ley de conservación de la materia
Las experiencias que llevaron a Lavoisier al descubrimiento de este principio tienen que ver con uno de los principales intereses de la química de la época: la combustión. Calentando diversos metales, el francés se dio cuenta de que ganaban masa al calcinarse si se dejaban expuestos al aire, pero que su masa permanecía idéntica si estaban en envases cerrados.
Así, dedujo que esa cantidad extra de masa provenía de algún lado. Propuso, entonces, su teoría de que la masa no era creada, sino tomada del aire. Por ende, en condiciones controladas, puede medirse la cantidad de masa de los reactivos antes del proceso químico y la cantidad de masa posterior, que deben ser necesariamente idénticas, aunque ya no lo sea la naturaleza de los productos.
Ejemplo de la Ley de conservación de la materia
Un perfecto ejemplo de esta ley lo constituye la combustión de hidrocarburos, en la que puede verse al combustible arder y “desaparecer”, cuando en realidad se habrá transformado en gases invisibles y agua.
Por ejemplo, al quemar metano (CH4) tendremos la siguiente reacción, cuyos productos serán agua y gases invisibles, pero de una cantidad de átomos idéntica que los reactivos:
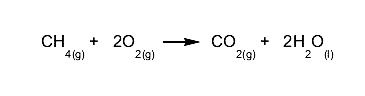
TAREA
1.- EN EL EJERCICIO ANTERIOR CALCULE LOS MOLES Y LOS PESOS Y DEMUESTRE QUE SON IGUALES
2.- ENVIAR TODAS LAS TAREAS AL CORREO dperalta.tareas.ocp@gmail.com
No hay comentarios:
Publicar un comentario