Ley combinada de los gases
La ley de Boyle, ley de Charles y ley de Gay Lussac se pueden combinar en una sola ley. La Ecuación plantea la relación entre la presión, el volumen y la temperatura de una cantidad fija de gas.
La presión es inversamente proporcional al volumen y directamente proporcional a la temperatura.
El volumen es directamente proporcional a su temperatura

*Los resultados de Presión serán expresados en atm(atmósferas), esto quiere decir que para convertir milímetros de mercurio(mm Hg) a atm (atmósferas), solo debes dividir entre 760 y el resultado les dará en atm(atmósferas). por ejemplo :

- Los resultados de Volumen serán expresados en litros, estoy es dividiendo entre 1000, para convertir de mililitros a litros, por ejemplo:
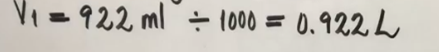
- Los grados Celsius o centigrados se deben convertir en grados Kelvin, esto es sumándole, el valor en centigrados mas 273, por ejemplo :


Ejercicios
1.-Hay un gas con 700 milímetros de Mercurio depresión en 922 ml de volumen a 20 grados Celsius. Calcula la temperatura final a 500 mm de mercurio con 451 ml.
2.- un gas ocupa un gas ocupa 205 mililitros a 20 grados centígrados y 1,05 atm .Calcule el volumen final a 60 grados centígrados y 2,4 Atmósferas de presión.
3.-

Química, Biología,Emprendedor #SocialMedia #Publicista #Escritor #Emelec #Blogero #DiseñadorGrafico
1.-Si cierta masa de gas contenido en un recipiente rígido a la temperatura de 100ºC posee una presión de 2 atm, ¿qué presión alcanzará la misma cantidad de gas si la temperatura aumenta a 473 K?
2.-Una cierta cantidad de gas se encuentra a la presión de 790 mm Hg cuando la temperatura es de 25ºC. Calcula la presión que alcanzará si la temperatura sube hasta los 200ºC.
3.-Un gas, a una temperatura de 35°C y una presión de 440 mm de Hg, se calienta hasta que su presión sea de 760 mm de Hg. …
Ejercicios con ley de Charles
1.-Un alpinista inhala 500 mL de aire a una temperatura de menos(-) 10 grados centígrados. Qué volumen ocupará el aire en sus pulmones si su temperatura corporal es de 37 grados centígrados.
2.-El volumen inicial de una cierta cantidad de gas es de 200 mL a la temperatura de 293 grados Kelvin.Calcule el volumen del gas si la temperatura asciende a 363 K y la presión se mantiene constante.
3.-Una cantidad fija de gas a 296 grados Kelvin ocupa un volumen de 10,3 Litros, determine la temperatura final del gas si alcanza un volumen de 23 litros a presión constante.
Ley de Boyle
1.-Un gas ocupa un volumen de 200 centímetros cúbicos a una presión de 700 milímetros de Mercurio cuál será su volumen si la presión recibida aumenta a 900 milímetros de Mercurio
2.- un gas ocupa 1,5 litros a una presión de 2.5 atm. Si la temperatura permanece constante cuál será la presión en milímetros de Mercurio si se pasa a un recipiente de 3 litros
TAREA
REALICE DOS EJERCICIOS DE LOS PROPUESTOS






No hay comentarios:
Publicar un comentario