Alcanos lineales: estructura, propiedades, nomenclatura, ejemplos
Los alcanos lineales son hidrocarburos saturados cuya fórmula química general es n-CnH2n+2. Al tratarse de hidrocarburos saturados, todos sus enlaces son simples (C-H) y se componen únicamente de átomos de carbono e hidrógeno. También reciben el nombre de parafinas, diferenciándolos de los alcanos ramificados a los cuales se les llaman isoparafinas.
Estos hidrocarburos carecen de ramificaciones y anillos. Más que líneas, esta familia de compuestos orgánicos se asemejan más a cadenas (Straight chain alkane); o desde un ángulo culinario, a espaguetis (crudos y cocinados).
Los espaguetis crudos vienen a representar el estado ideal y aislado de los alcanos lineales, aunque con una pronunciada tendencia a quebrarse; mientras que los cocinados, sin importar que estén al dente o no, se aproximan a su estado natural y sinérgico: unos interaccionando con otros en un todo (el plato de pasta, por ejemplo).
Este tipo de hidrocarburos se encuentran naturalmente en el gas natural y en los yacimientos petroleros. Los más livianos presentan características lubricantes, mientras que los pesados se comportan como un asfalto indeseable; soluble, sin embargo, en parafinas. Sirven muy bien como solventes, lubricantes, combustibles y asfaltos
Estructura de los alcanos lineales
Grupos
Se hizo mención de que la fórmula general de estos alcanos es CnH2n+2. Esta fórmula es la misma de hecho para todos los alcanos, sean lineales o ramificados. La diferencia entonces en la n- que antecede la fórmula del alcano, cuya denotación quiere decir “normal”.
Se verá más adelante que esta n- es innecesaria para alcanos con un número de carbono igual o menor a cuatro (n ≤ 4).
Una línea o cadena no puede constar de un único átomo de carbono, por lo que se descarta para la explicación el metano (CH4, n = 1). Si n = 2, tenemos el etano, CH3-CH3. Nótese que este alcano consiste de dos grupos metilos, CH3, enlazados entre sí.
Aumentando el número de carbonos, n = 3, se obtiene el alcano propano, CH3-CH2-CH3. Ahora aparece un nuevo grupo, CH2, llamado metileno. No importa qué tan grande sea el alcano lineal, siempre tendrá dos grupos nada más: CH3 y CH2.
Longitudes de sus cadenas
Cuando aumenta n o el número de carbonos del alcano lineal, hay una constante en todas las estructuras resultantes: se incrementa el número de grupos metilenos. Por ejemplo, supóngase los alcanos lineales con n = 4, 5 y 6:
CH3-CH2-CH2-CH3 (n-butano)
CH3-CH2-CH2-CH2-CH3 (n-pentano)
CH3-CH2-CH2-CH2-CH2-CH3 (n-hexano)
Las cadenas se vuelven más largas porque adicionan a sus estructuras grupos CH2. Así, un alcano lineal extenso o corto difiere en cuántos CH2 separa a los dos grupos terminales CH3. Todos estos alcanos tienen nada más dos estos CH3: al principio de la cadena y al final de la misma. Si tuviera más, implicaría la presencia de ramificaciones.
Asimismo, puede verse la ausencia total de los grupos CH, presentes solo en las ramificaciones o cuando hay grupos sustituyentes enlazados a uno de los carbonos de la cadena.
La fórmula estructural puede resumirse de la siguiente manera: CH3(CH2)n-2CH3. Intente aplicarla e ilustrarla.
Conformaciones
Algunos alcanos lineales pueden ser más largos o cortos que otros. Siendo así, n puede tener un valor de 2 a ∞; esto es, una cadena compuesta infinitos grupos CH2 y dos grupos CH3 terminales (en teoría es posible). Sin embargo, no todas las cadenas se “acomodan” de la misma manera en el espacio.
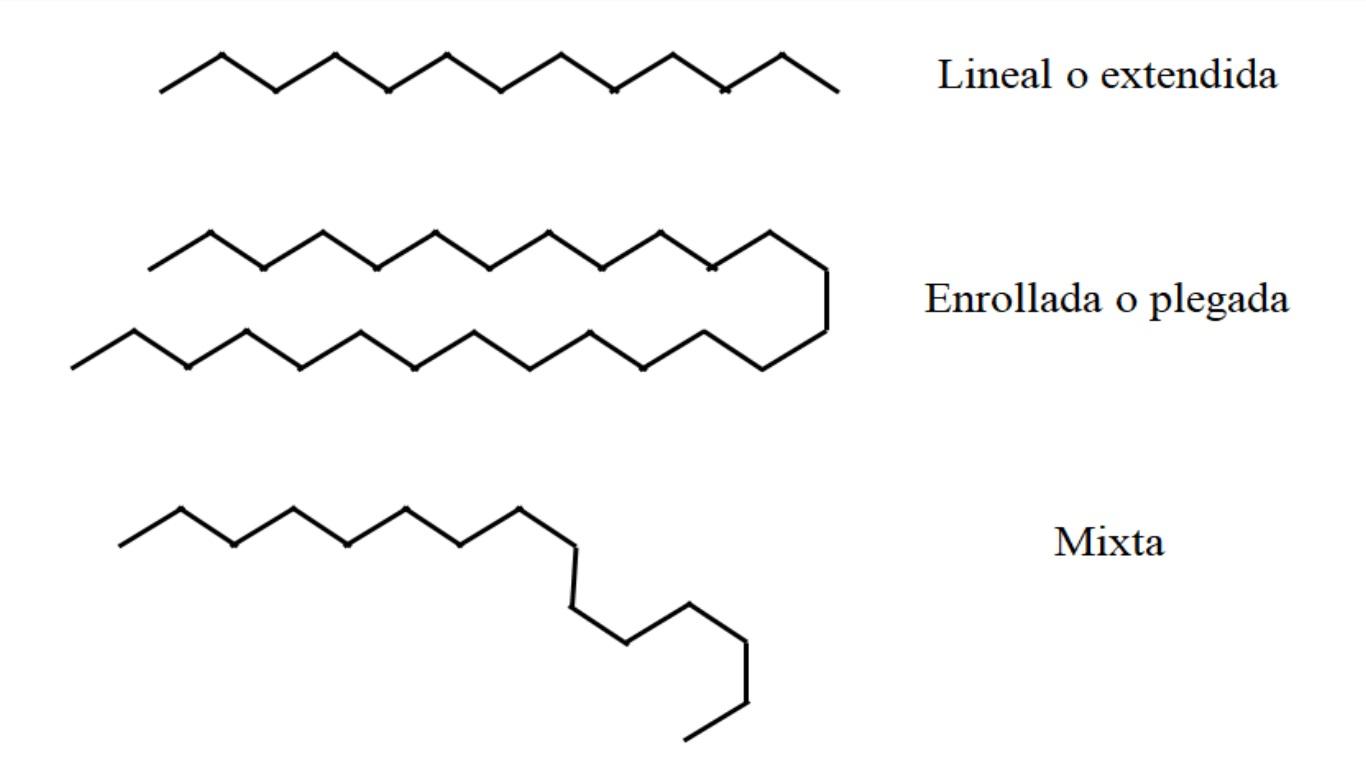
Es aquí donde surgen las conformaciones estructurales de los alcanos. ¿A qué se deben? A la rotabilidad de los enlaces C-H y la flexibilidad de los mismos. Cuando estos enlaces giran o rotan entorno a un eje internuclear, las cadenas comienzan a flexionarse, plegarse o enrollarse, alejándose de su característica lineal original.
Lineal
En la imagen superior, por ejemplo, se muestra en la parte más alta una cadena de trece carbonos que permanece lineal o extendida. Esta conformación es la ideal, ya que se asume que el entorno molecular afecta en lo mínimo la disposición espacial de los átomos de la cadena. Nada la perturba y no tiene necesidad de doblarse.
Enrollada o plegada
En el medio de la imagen, la cadena de veintisiete carbonos experimenta una perturbación externa. La estructura, para hallarse más “cómoda”, rota sus enlaces de tal manera que vaya plegándose sobre sí misma; tal como un espagueti largo.
Estudios computacionales demostraron que el máximo número de carbonos que puede tener una cadena lineal es de n = 17. A partir de n = 18, es imposible que no empiece a doblarse o enrollarse.
Mixta
Si la cadena es muy larga puede haber regiones de la misma que permanezcan lineales mientras otros se hayan doblado o enrollado. De todas, esta es quizás la conformación más cercana a la realidad.
Propiedades
Físicas
Al tratarse de hidrocarburos, son en esencia apolares, y por tanto, hidrofóbicos. Esto significa que no pueden mezclarse con el agua. Son poco densos debido a que sus cadenas dejan demasiados espacios vacíos entre ellas.
Asimismo, sus estados físicos van desde gaseosos (para n < 5), líquidos (para n < 13) o sólidos (para n ≥ 14), y dependen de la longitud de la cadena.
Interacciones
Las moléculas de los alcanos lineales son apolares, y por lo tanto, sus fuerzas intermoleculares son de tipo dispersión de London. Las cadenas (probablemente adoptando una conformación mixta), se atraen entonces por acción de sus masas moleculares y los dipolos inducidos instantáneos de sus átomos de hidrógeno y carbono.
Es por esta razón que cuando la cadena se vuelve más larga, y por ende, más pesada, aumenta de igual modo sus puntos de ebullición y fusión.
Mientras más larga sea la cadena, más inestable es. Por lo general, sufren rupturas de sus enlaces para originar cadenas más pequeñas a partir de una grande. De hecho, a este proceso se le conoce como craqueo, altamente utilizado en la refinación del petróleo.
Nomenclatura
Para nombrar los alcanos lineales basta con adicionar el indicador n- antes del nombre. Si n = 3, como ocurre con el propano, se tiene que es imposible que este alcano presente ramificación alguna:
CH3-CH2-CH3
Cosa que no ocurre a partir de n = 4, es decir, con el n-butano y los demás alcanos:
CH3-CH2-CH2-CH3
O
(CH3)2CH-CH3
La segunda estructura corresponde al isobutano, el cual consiste de un isómero estructural del butano. Para diferenciar uno de otro, entra en juego el indicador n-. Así, el n-butano se refiere únicamente al isómero lineal, sin ramificaciones.
Mientras mayor sean n, mayor será el número de isómeros estructurales y mayor importancia tendrá utilizar n- para referirse al isómero lineal.
Por ejemplo, el octano, C8H18 (C8H8×2 + 2), presenta hasta trece isómeros estructurales, ya que son posibles muchas ramificaciones. El isómero lineal, sin embargo, se nombra: n-octano, y su estructura es:
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3
Ejemplos
Se mencionan a continuación y para finalizar algunos alcanos lineales:
-Etano (C2H6): CH3CH3
-Propano (C3H8): CH3CH2CH3
–n-Heptano (C7H16): CH3(CH2)5CH3.
– n-Decano (C10H22): CH3(CH2)8CH3.
–n-Hexadecano (C16H34): CH3(CH2)14CH3.
–n-Nonadecano (C19H40): CH3(CH2)17CH3.
–n-Eicosano (C20H42): CH3(CH2)18CH3.
– n-Hectano (C100H202): CH3(CH2)98CH3.

No hay comentarios:
Publicar un comentario