LEY DE BOYLE Y MARIOTTE:
Ahora
veremos como se relaciona la presión de un gas, en función de su
volumen. Un ejemplo sencillo que puede ayudarte es cuando tienes un
globo inflado a temperatura ambiente y le hace fuerza con nuestra mano
desde el exterior. Notaremos que la deformación del globo hace que el
volumen se achique y que a su vez se observe cierta tensión sobre la
pared interior del mismo. Ese cambio es consecuencia de un aumento de
presión interna, lo que nos permite inferir que en un recipiente cuando disminuimos su volumen la presión aumenta. Hablando con mas propiedad, definiremos que a temperatura constante, la presión que ejerce de un gas ideal es directamente proporcional al volumen que ocupa.
La
expresión de este comportamiento de los gases en Física se conoce con
el nombre de ley de Boyle-Mariotte y matemáticamente se expresa por esta
fórmula: donde los subíndices i y f indican, respectivamente, las
condiciones iniciales y finales del proceso.
Ejemplo: En
el recipiente de abajo, el volumen es de 45 litros y la presión inicial
es la atmosférica, ósea, 1 atm. ¿Que presión experimentará si bajamos
el émbolo de tal modo que el volumen ahora es de 3 litros?
Volumen Inicial: Vi=45
Volumen Final: Vf=3
Volumen Final: Vf=3
Presión Inicial: Pi=1
Presión Final: ? (incógnita)
Presión Final: ? (incógnita)
Aplicando la formula de la Ley de Boyle – Mariotte es: 1 x 45 = 3 x Pf ==> Pf=(1 x 45)/3=15 atm.
También se puede expresa la Ley d Boyle-Mariotte: A temperatura constante p. v = cte.
Para el caso de aquí abajo
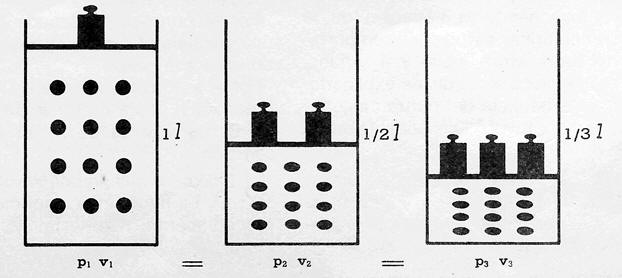
p1.v1=p2.v2=p3.v3
Ley de Boyle-Mariotte: los volúmenes que ocupa una misma masa de gas, a temperatura constante,
son inversamente proporcionales a sus presiones.
Ley de Boyle-Mariotte: los volúmenes que ocupa una misma masa de gas, a temperatura constante,
son inversamente proporcionales a sus presiones.
GRÁFICAMENTE SE PUEDE EXPRESA ASI:
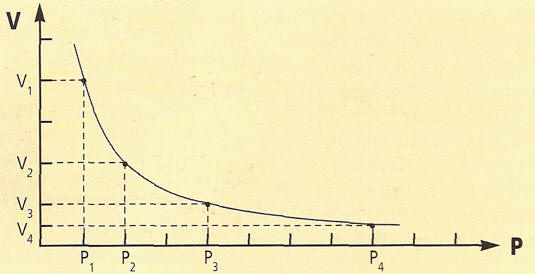
LEY DE BOYLE-MARIOTTE:
Una masa de gas ocupa un volumen que está determinado por la presión y
la temperatura de ese gas. Las leyes de los gases estudian el
comportamiento de una determinada masa de gas, si una de esas magnitudes
permanece constante. Boyle observó que cuando la presión aumentaba, el
volumen se reducía, y, a la inversa, que cuando la presión disminuía, el
volumen aumentaba. De esta manera la ley de Boyle establece que: El volumen de una determinada masa de gas, a temperatura constante, es inversamente proporcional a la presión de ese gas.
LEY DE CHARLES GAY – LUSSAC A PRESIÓN CONSTANTE
En
1787, el físico francés Jacques Charles reflota un viejo postulado
enunciado en 1699 por el francés Guillaume Amontons (1663-1705). Éste
había observado que el volumen de un gas, a presión constante, disminuía
a medida que bajaba la temperatura. La misma comprobación fue realizada
cinco años después por Joseph Gay-Lussac (1778-1850). Amontons queda en
el olvido, y la ley se conoce hoy como ley de Charles y Gay-Lussac. Su
enunciado es el siguiente:
El volumen de una determinada masa gaseosa, a presión constante,
es directamente proporcional a su temperatura absoluta.
es directamente proporcional a su temperatura absoluta.
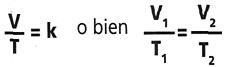
V=volumen y T=temperatura
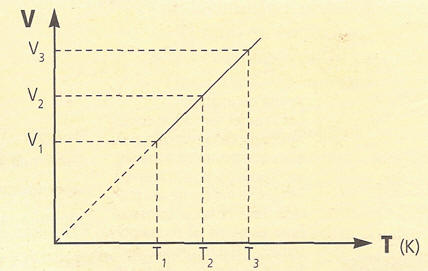
LEY DE CHARLES GAY – LUSSAC A VOLUMEN CONSTANTE
Luego
de varios experimentos, Charles y Gay-Lussac llegaron a la conclusión
de que a volumen constante, la presión aumenta con el aumento de
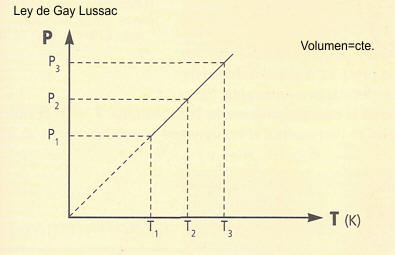
temperatura. La ley de Charles y Gay-Lussac establece que:
La presión de una determinada masa gaseosa a volumen constante
es directamente proporcional a su temperatura absoluta.
es directamente proporcional a su temperatura absoluta.
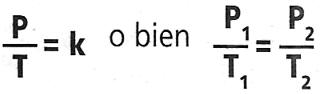
P=presión y T=temperatura
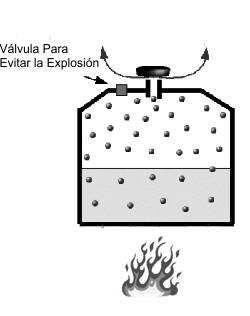
Ejemplo: Cuando se calienta agua en una olla de presión, el volumen no varia, por lo que aumenta
la presión del vapor de agua hasta que el exceso sale por la válvula de seguridad (de lo contrario, explotaría).
la presión del vapor de agua hasta que el exceso sale por la válvula de seguridad (de lo contrario, explotaría).
ECUACIÓN GENERAL DE LOS GASES IDEALES:
La
ley de Boyle y las leyes de Charles y Gay-Lussac pueden relacionarse
matemáticamente mediante la ecuación de estado del gas ideal, que
resulta útil cuando se quiere modificar las tres magnitudes, siempre que
la masa del gas permanezca constante y la temperatura se exprese en
escala Kelvin.
Hasta
ahora hemos visto las siguiente situaciones particulares, llamando a
cada una según el científico que las estudió. Ahora las tres se pueden
unificar en una sola fórmula.
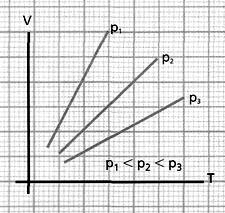
Si
se aumenta la temperatura de un gas, manteniendo su presión constante,
el volumen que ocupa crece proporcionalmente a la temperatura absoluta.
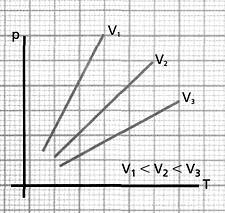 Si
se aumenta la temperatura de un gas, manteniendo su volumen constante,
la presión que el gas ejerce sobre las paredes del recipiente crece
proporcionalmente a la temperatura absoluta.
Si
se aumenta la temperatura de un gas, manteniendo su volumen constante,
la presión que el gas ejerce sobre las paredes del recipiente crece
proporcionalmente a la temperatura absoluta.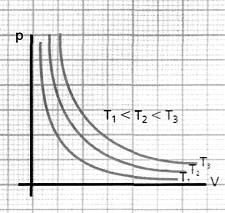 Si se reduce el volumen de un gas, manteniendo su temperatura constante, la presión
Si se reduce el volumen de un gas, manteniendo su temperatura constante, la presióncrece de manera inversamente proporcional al volumen.
Ecuación de estado del gas ideal:
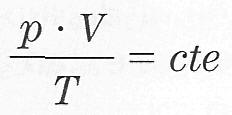
O también:
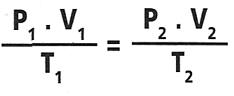
Donde
el valor de la constante depende de la cantidad de gas en cuestión, y T
es la temperatura absoluta (en grados Kelvin). Esta ecuación general de
estado del gas ideal es útil pues relaciona entre sí todas las
variables de estado del sistema. Esto significa que, si conocemos los
valores de dos cualesquiera de ellas, la tercera queda completamente
determinada.
Debe
tenerse en cuenta que las temperaturas han de calcularse en grados
absolutos o Kelvin. Éstas se obtienen sumando 273 a las temperaturas
obtenidas con la graduación centígrada. Así, la temperatura ambiente de
22o se transforma en 295o absolutos o K.
Ejemplo Numérico:
Supongamos un globo que contiene 10 litros de aire a la presión normal,
es decir, a una atmósfera y a la temperatura de 18° centígrados. ¿Cuál
será su volumen si la temperatura aumenta 10°?
Determinemos, primero, las temperaturas inicial y final de este cambio:
Ti = 18°C + 273° = 291 °K
Tf = (18 + 10) °C + 273° = 301 °K
Ti = 18°C + 273° = 291 °K
Tf = (18 + 10) °C + 273° = 301 °K
y, luego, teniendo en cuenta la proporcionalidad directa entre volumen y temperatura,
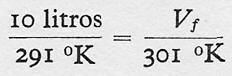
y operando, se tiene: Vf= 10 l. x 301° / 291° = 10,34 litros
¿Cómo podemos resolver un problema en el que varíen simultáneamente el volumen, la presión y la temperatura?
Como
se explicó antes, combinando las leyes anteriores se llega a la
expresión, de Ley de los Gases Perfectos. que nos permite calcular una
de las magnitudes en función de las otras. Así, si queremos calcular el volumen final, despejando, tenemos:
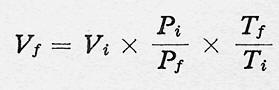
Ecuación General del gas Ideal es:
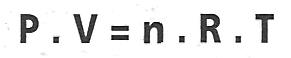
Donde n es el número de moles presentes y R es una constante –cuyo valor depende e las magnitudes y unidades empleadas– igual a 0,082 dm3.
atm / mol . k. Esta ecuación es sumamente interesante si queremos
hallar alguna de las magnitudes y corlemos el resto de las mismas.
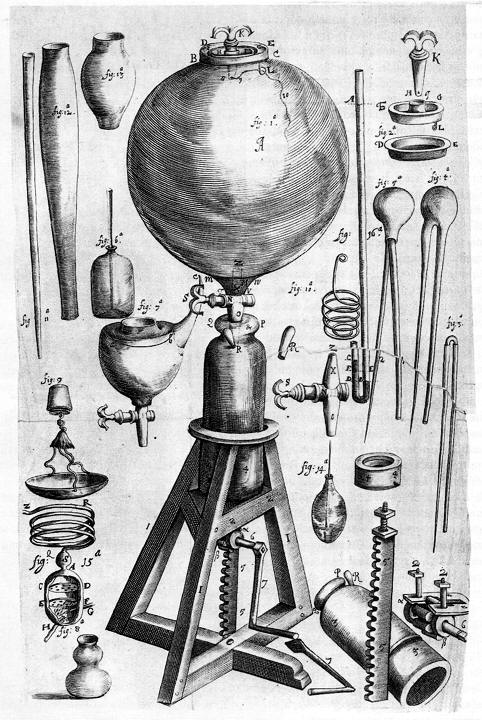
Lámina donde se muestran los instrumentos del laboratorio de Boyle.

Lámina
de «Observations on differents kinds of air» (Philosophical
Transactions ofthe Royal Society, 1772; también aparece en el libro
titulado Experiments and Observations on Differents Kinds of Air
publicado en 1774). de Joseph Priestley, mostrando uno de sus
experimentos para demostrar los efectos de la combustión, putrefacción y
respiración en una planta de menta y en ratones.
Fuente Consultada: QUÍMICA I Polimodal
FÍSICA II Polimodal
CONSULTORA Enciclopedia Temática Ilustrada Tomo 10 El Mundo Físico.
Historia de las Ciencias Desiderio Papp
No hay comentarios:
Publicar un comentario