NITRILOS
¿QUE SON?
FORMULA GENERAL
ESTRUCTURA DE LOS NITRILOS
 |
| tridimencional |
| C | Nombre del compuesto | Estructura | PM (g/mol) | P.Fus. (ºC) | P.Eb. (ºC) |
|---|---|---|---|---|---|
| 1 | cianuro de hidrógeno | 27,0 | -13,24 | 25,7 | |
| 2 | acetonitrilo o etanonitrilo | 41,0 | -45 | 81 | |
| 3 | propionitrilo o propanonitrilo | 55,1 | -92 | 97 | |
| 4 | butironitrilo o butanonitrilo | 69,1 | -112 | 116-118 | |
| 5 | pentanonitrilo | 83,1 | -96 | 139 | |
| 6 | hexanonitrilo | 97 | -80 | 161-164 | |
| 7 | heptanonitrilo o caprilonitrilo | 111,2 | -64 | 186-187 | |
| 8 | octanonitrilo | 125,2 | -45 | 198-200 | |
| 9 | nonanonitrilo o pelargononitrilo | 139,2 | -35 | 224 | |
| 10 | decanonitrilo1 | 153,3 | N/D | 241-243 |
Hay tres reglas para nombrarlos :
Regla 1.
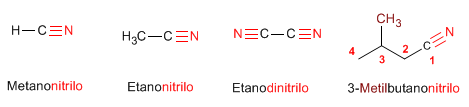 Regla 2. Cuando se aňaden como sustituyentes, el compuesto se nombra poniendo "el prefijo" ciano - delante del nombre de la cadena principal. 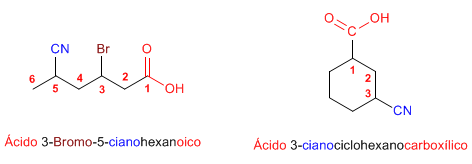 Regla 3. Cuando los nitrilos se unen a los ciclos, los compuestos los nombramos poniendo detrás del nombre del anillo "el sufijo" -carbonitrilo 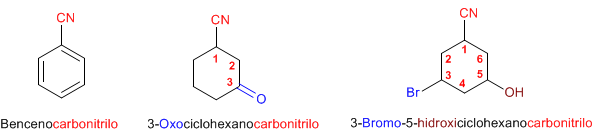 |
PROPIEDADES FÍSICAS
- Los primeros términos de la serie son líquidos, los superiores ( mas de 14 carbonos) son sólidos.
- Los nitrilos de bajo peso molecular son solubles en el agua.
- Los nitrilos de bajo peso molecular son líquidos a temperatura ambiental (excepto el HCN).
- Son mas densos que el agua.
- La temperatura de ebullición de los nitrilos es generalmente superior a los ácidos correspondientes.
- Son
usados como venenos para insectos, bacterias, hongos en la agricultura,
conformando algunos insecticidas, bactericidas y fungicidas
respectivamente.

PROPIEDADES QUÍMICAS
El olor de recuerda al del cianuro de hidrógeno y son
moderadamente tóxicos.
Los
nitrilos, aunque no contienen el enlace C=O, se consideran a veces como
derivados funcionales de los ácidos carboxílicos porque en la reacción
de hidrólisis (en medios ácidos o básicos) se transforman en ácidos
carboxílicos y sales de amonio.
R - CN + 2H2 --> R - COOH + NH3
Los nitrilos adicionan hidrógeno en presencia de un catalizador produciendo aminas = hidrogenación
CH3 - CN + 2H2 --> CH3 - CH2 - NH2
R - CN + 2H2 --> R - COOH + NH3 Los nitrilos adicionan hidrógeno en presencia de un catalizador produciendo aminas = hidrogenación
CH3 - CN + 2H2 --> CH3 - CH2 - NH2
OBTENCIÓN

Los nitrilos aromáticos se obtienen a partir de una amina, transformándola primero a una sal de diazonio y tratándola posteriormente con cianuro cuproso (CuCN).

- Obtención 1: Sintesis nitrilica de Kolbe
ejemplo:

El isocianuro de alquilo se puede separar de la mezcla por agitación con ácido
clorhídrico diluido en frió. La alquilacion del ion cianuro bidentado transcurre según el mecanismo Sn2 y se produce preferentemente sobre el átomo de C fuertemente nucleofilo y solo es muy pequeña medida en el átomo de N.
Los halogenuros de alquilo muestran en la serie ioduro, bromuro y cloruro una velocidad de reacción decreciente; sin embargo, la reacción se encuentra también influida por la estructura del grupo alquilo
- Por calentamiento de las amidas con agentes deshidratantes:

- Por calentamiento de las aldoximas con anhidrido acético, con separación de agua:





No hay comentarios:
Publicar un comentario