Neutralización ácido base
La más común es la reacción de un ácido fuerte contra una base fuerte. Algunos ejemplos veremos a continuación para mostrar casos de neutralización.
HCl + NaOH —-> NaCl + H2O
En este caso vemos al ácido clorhídrico contra el hidróxido de sodio. Genera cloruro de sodio y agua. En este caso basta una molécula de ácido con una molécula de la base para generar la sal. Pero no siempre es asi
2 NaOH + H2SO4 —-> Na2SO4 + 2 H20
Aquí se necesitan 2 moléculas de la base contra 1 del ácido para formar el sulfato de sodio.
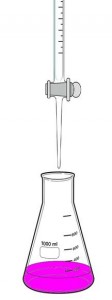
Este principio se usa para averiguar la molaridad de un ácido o de una base gracias a un procedimiento llamado valoración acido base o titulación acido base. Por ejemplo, si se quiere averiguar la molaridad de un ácido se coloca a la solución de este en un erlenmeyer y se la enfrenta con otra solución de un hidróxido de concentración excatmente conocida. Esta solución de la base se la coloca en una bureta quedando por encima del erlenmeyer que tiene la solución problema del ácido. Colocamos una gota de un indicador en el erlenmeyer para que nos indique el momento exacto en el cual se ha producido la neutralización, o sea, cuando no haya exceso de base ni ácido, por ejemplo la fenolftaleína. Dejamos caer gota a gota desde la bureta al Erlenmeyer haciendo movimiendos suaves y circulares para una correcta titulación. Apenas vemos un cambio de coloración al rosa cesamos al agregado de la solución de hidróxido de sodio. Medimos el volumen agregado de la solución de NaOH y hacemos los cálculos correspondientes.
Este principio se usa para averiguar la molaridad de un ácido o de una base gracias a un procedimiento llamado valoración acido base o titulación acido base. Por ejemplo, si se quiere averiguar la molaridad de un ácido se coloca a la solución de este en un erlenmeyer y se la enfrenta con otra solución de un hidróxido de concentración excatmente conocida. Esta solución de la base se la coloca en una bureta quedando por encima del erlenmeyer que tiene la solución problema del ácido. Colocamos una gota de un indicador en el erlenmeyer para que nos indique el momento exacto en el cual se ha producido la neutralización, o sea, cuando no haya exceso de base ni ácido, por ejemplo la fenolftaleína. Dejamos caer gota a gota desde la bureta al Erlenmeyer haciendo movimiendos suaves y circulares para una correcta titulación. Apenas vemos un cambio de coloración al rosa cesamos al agregado de la solución de hidróxido de sodio. Medimos el volumen agregado de la solución de NaOH y hacemos los cálculos correspondientes.
Ejemplo: Se consumieron 60 ml de NaOH 0,4 M contra un volúmen de H2SO4 en el erlenmeyer de 100 ml.
Los moles agregados de NaOH son:
0,4 M x 0,060 litros: 0,024 moleS.
Según la reacción, la cantidad de moles de NaOH es el doble del H2SO4: Entonces de H2SO4 habrán 0,012 moles. La molaridad de H2SO4 será:
M = 0,012 moles / 0,1 litro (100 ml)
M = 0,12 M
M = 0,12 M
TAREA
1. LEA LA PAGINA 166 DEL TEXTO Y REALICE UN MAPA CONCEPTUAL EN SU CUADERNO.
2. EN UNA HOJA PERFORADA REALICE TRES EJEMPLOS DE NEUTRALIZACIÓN.
3. RECUERDE SI NO ES NECESARIO. "QUÉDESE EN CASA"
No hay comentarios:
Publicar un comentario