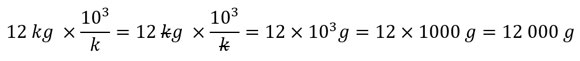Métodos
Para equilibrar o balancear ecuaciones químicas, existen diversos métodos'. En todos, el objetivo que se persigue es que la ecuación química cumpla con la ley de la conservación de la materia.
Método de tanteo
Consiste en que las dos ecuaciones tengan los átomos de cada elemento químico en igual cantidad, aunque estén en moléculas distintas (en diferentes sustancias).
Para ello, recordaremos que...
- En una molécula H2SO4 hay 2 Hidrógenos, 1 Azufre y 4 Oxígenos.
- En 5 moléculas de H2SO4 habrá 10 Hidrógenos, 5 azufres y 20 Oxígenos.
Para equilibrar ecuaciones, solo se puede agregar coeficientes a las formulas que lo necesiten, pero no se puede cambiar los subíndices.
- Ejemplo: Balancear la siguiente ecuación:
- Agua + Óxido de nitrógeno(V) = Ácido nítrico
- H2O + N2O5 → HNO3
Tal como se ha escrito, vemos que en el 1er. miembro hay 2 hidrógenos, mientras que en el 2º hay solo uno; a la izquierda hay 2 nitrógenos liquidos y a la derecha hay uno; en el sistema inicial hay 6 oxígenos y al final solamente hay 3. Normalmente, el ajuste se inicia con el elemento menos "frecuente", en nuestro caso el nitrógeno. Para ajustar el nitrógeno, podemos añadir otra molécula de HNO3 en el 2º miembro: - H2O + N2O5 → HNO3 + HNO3
Al contar el número de átomos de cada tipo, veremos que es igual al principio y al final. Para evitar tener que "dibujar" las moléculas, se pone su número delante de su fórmula; aquí, se inserta un "2"(coeficiente) delante de HNO3, y la ecuación queda equilibrada. - H2O + N2O5 → 2 HNO3
|
- Veamos otro ejemplo, secuenciado:
Nos piden ajustar el siguiente proceso químico: Cuando el sulfuro de hidrógeno reacciona con aluminio metálico, se produce sulfuro de aluminio y se desprende hidrógeno gaseoso. ¡Es muy importante escribir correctamente la fórmulas químicas de las sustancias indicadas! - H2S + Al → Al2S3 + H2
1.- Empezamos por equilibrar el aluminio: - H2S + 2 Al → Al2S3 + H2
2.- Continuamos con el azufre: - 3 H2S + 2 Al → Al2S3 + H2
3.- y por último, el hidrógeno: - 3 H2S + 2 Al → Al2S3 + 3 H2
|
- Existe otro método de igualación, que se conoce como coeficientes indeterminados.
Usemos como ejemplo esta misma reacción. En la aplicación, se asigna a cada sustancia una letra como coeficiente: - A H2S + B Al → C Al2S3 + D H2
A continuación construimos una ecuación para cada elemento presente, usando los subíndices y la ley de conservación de la masa: - Para el H : 2 A = 2 D
- Para el Al : B = 2 C
- Para el S : A = 3 C
Hemos conseguido tres ecuaciones, porque hay tres elementos químicos distintos. Después, se asigna una valor numérico al coeficiente que se desee. Por ejemplo, demos a A el valor "1". Entonces, según la 1ª ecuación, D también valdrá "1" y C valdrá "1/3". Con ello, B tendrá un valor de "2/3". Según esto, la ecuación quedará como... - 1 H2S + 2/3 Al → 1/3 Al2S3 + 1 H2
Para evitar el uso de coeficientes fraccionarios, se multiplica todo por "3", con lo cual la reacción vuelve a quedar como... - 3 H2S + 2 Al → Al2S3 + 3 H2
|
Método de Redox
- Metodo de Oxido-Reduccion
- Existen reacciones complejas, especialmente difíciles de ajustar por estos métodos. Un ejemplo particular son los llamados procesos redox, donde una especie química gana electrones (se reduce) mientras otra pierde electrones (se oxida).
- En una reacción donde un elemento se oxida (reductor, pierde electrones) otro elemento se reduce (oxidante, gana electrones).
este metodo de balanceo es el mas utilizado en el proceso quimico. Para balancear este tipo de ecuaciones hay varios métodos especiales, basados en el uso del llamado número de oxidación (en adelante NO), que es un número no real, que nos indica la carga de un átomo -dentro de una molécula-, imaginando que todos los enlaces de ésta fuesen iónicos. Para calcularlo, hay que aplicar ciertas reglas:
- 1) Para un elemento no combinado, vale cero.
- 2) Para un ión mono-atómico, es la propia carga del ión.
- 3) Para el hidrógeno combinado vale +1, excepto en hidruros metálicos (donde vale -1).
- 4) Para el oxígeno combinado es -2, excepto en los peróxidos, en cuyo caso es -1.
- 5) En un compuesto covalente sin H ni O, se aplica NO negativo al elemento más electronegativo (consultar concepto de electro-negatividad)
- 6) En un ión poliatómico, la suma de los NO es igual a la carga del ión.
- 7) Si se trata de una molécula, la suma de los NO vale cero.
Nosotros indicaremos el NO de cada elemento como un número en rojo.
- Por vía de ejemplo vamos a calcular el número de oxidación del azufre (S) en la molécula de sulfato ferroso.
- El sulfato ferroso tiene la fórmula FeSO4 donde existen dos iones: el ión ferroso, Fe+++ y el ión sulfato, (SO4)=.
- El S está incluído dentro de un ión poliatómico, el ión sulfato. Por tanto, podemos aplicar la regla nº 6, apoyándonos en la regla nº 4. Así tendríamos que...
- 1.(x) + 4.(-2) = -2
- Lo que nos deja: x + 4(-2) = -2
- Y esto nos da un valor de x = +6
- No obstante, el cálculo también se podría hacer con la regla nº 7, y apoyándonos en la regla nº 2 (recordando que la valencia del ión ferroso es (+2)):
- Para el FeSO4, se tendrá que...
- 1.(+2) + 1.(x) + 4.(-2) = 0
- Que queda como... +2 + x + 4.(-2) = 0
- Y de nuevo, x = +6
- Veamos otro ejemplo algo más complicado: Nos piden el NO del cromo en el dicromato potásico, K2Cr2O7.
- Podemos aplicar la regla nº 7, sabiendo que el potasio, K, tiene valencia +1:
- 2.(+1) + 2.(x) + 7.(-2) = 0
- Por lo cual,
- 2 + 2.x - 14 = 0 y el resultado es x = +6
- Un caso especial es el cálculo del NO del nitrógeno en el nitrato amónico.
- Aquí se presenta una complejidad, puesto que esta sustancia tiene por fórmula NH4NO3. Pero debemos pensar que, al ser una sal, contiene dos iones: el amonio, (NH4)+, y el nitrato, (NO3)-.
- En el primero, x + 4.(+1) = +1
- x = +1 - 4 = -3
- En el segundo ión, x + 3.(-2) = -1
- x = -1 + 6 = +5
- Es decir, que el nitrógeno, en el nitrato amónico, al estar en dos iones distintos, presenta dos "estados de oxidación" diferentes.
Una vez sabido el número de oxidación, se puede usar el método de ajuste conocido como método del ión-electrón, sobre todo para reacciones en disolución acuosa, porque presenta varias ventajas: se puede operar solo con iones, da cierta idea del grado de acidez del fenómeno, indica si el sistema se diluye ó no...
De nuevo hay una serie de reglas, que en este caso deben aplicarse correlativamente:
- 1). Se hallan los NO cambiantes.
- 2). Se escriben los iones donde estén los elementos cambiantes (o las moléculas, si no hay iones), haciendo dos semirreacciones, una de oxidación y otra para la reducción.
- 3). Igualamos, en cada miembro de las semirreacciones, el número de átomos del elemento cambiante.
- 4). Se expresa el cambio del NO, siempre sumando electrones, y teniendo en cuenta el número de átomos.
- 5). Se igualan cargas eléctricas en ambos miembros...
- A) En medio ácido se hace con iones H+
- B) En medio alcalino, se hace con iones (OH)-
- 6). Igualamos la cantidad de H, sumando moléculas H2O en el miembro deficitario.
- 7). Multiplicamos por los números necesarios para simplificar los electrones al sumar las dos semirreacciones.
- 8). Se termina de ajustar el proceso total, dejando para el final los coeficientes de H+ y (OH)-
Pero lo mejor para aprender el método es realizar multitud de ejemplos. Veamos algunos...
- Los iones permanganato reaccionan con los iones ferrosos, en medio ácido, produciendo una sal manganosa e iones férricos. Se pide ajustar la reacción.
- El primer paso es escribir la ecuacion del fenómeno:
- (MnO4)- + Fe++ + H+ → Mn++ + Fe+++
- Al hallar los NO, vemos que el Mn pasa de +7 a +2, mientras que el Fe pasa de +2 a +3. Por eso escribiremos...
- (Mn+7O4)- → (Mn+2)++
- (Fe+2)++ → (Fe+3)+++
- Se observa que el número de átomos de Mn, y de Fe, se hallan igualados en ambos miembros, por lo que saltamos el tercer paso.
- Para el 4º paso, haremos...
- (Mn+7O4)- + 5 e- → (Mn+2)++
- (Fe+2)++ → (Fe+3)+++ + 1 e-
- Hay una semirreacción de reducción (la del Mn), y otra de oxidación (porque el Fe pierde un electrón).
- En el 5º paso, como el medio es ácido (¡ya lo indica el icono H+!), debemos ajustar cargas eléctricas con iones H+ :
- (MnO4)- + 5 e- + 8 H+ → Mn++
- Fe++ → Fe+++ + 1 e- , ¡que ya está equilibrada!
- El 6º paso se refiere a hacer lo siguiente:
- (MnO4)- + 5 e- + 8 H+ → Mn++ + 4 H2O
- Fe++ → Fe+++ + 1 e-
- Para aplicar el 7º paso, la segunda semirreacción debe multiplicarse por 5, con lo cual, al sumar ambos procesos (eliminando los electrones), queda...
- (MnO4)- + 8 H+ + 5 Fe++ → Mn++ + 5 Fe+++ + 4 H2O
- Así vemos que el proceso se desarrolla en un medio ácido relativamente fuerte, y que a lo largo de la reacción el sistema se diluye, porque se forma agua.
- Si -posteriormente- se van a hacer cálculos estequiométricos con la reacción propuesta, conviene escribir las sustancias completas, y terminar el ajuste, aunque es posible que se deban hacer algunas mínimas modificaciones en los coeficientes.
- En otro caso, el peróxido de hidrógeno reacciona con el cloruro de zinc(I), produciendo agua y cloruro de zinc(II). ¿Cuáles son los coeficientes de cada fórmula?
- La ecuación es H2O2 + ZnCl → H2O + ZnCl2
- Rápidamente se observa que el NO del oxígeno pasa de -1 (¡es un peróxido!) a -2, mientras que el zinc cambia de +1 a +2 (esto se sabe porque ambas sales presentan estos iones). Ni el hidrógeno ni el cloro sufren variación.
- Advertimos que el NO del O se hace más negativo, (se reduce) y el NO del Zn se hace más positivo, (pierde electrones, se oxida). Así pues, escribimos:
- H2O2-1 → H2O-2 y se escribe la molécula entera porque son sustancias covalentes
- (Zn+1)+ → (Zn+2)++
- 3er. paso:
- H2O2-1 → 2 H2O-2
- (Zn+1)+ → (Zn+2)++
- 4º paso
- H2O2-1 + 2 e- → 2 H2O-2 ¡porque en el peróxido hay dos O, y cada uno gana un electrón!.............REDUCCIÓN
- (Zn+1)+ → (Zn+2)++ + 1 e-..........................................................OXIDACIÓN
- 5º paso. Como no se indica la acidez del medio, tomaremos medio ácido:
- H2O2-1 + 2 e- + 2 H+ → 2 H2O-2
- (Zn+1)+ → (Zn+2)++ + 1 e- ; está equilibrada
- 6º paso:
- Como el número de H está igualado, podemos saltarnos el 6º paso.
- 7º paso:
- Multiplicamos por 2 el proceso de oxidación y sumamos, con lo cual el número de electrones se anula (por estar en distinto miembro algebraico) y nos queda...
- H2O2 + 2 H+ + 2 (Zn)+ → 2 H2O + 2 (Zn)++
- 8º paso:
- Los coeficientes obtenidos se trasladan al proceso general:
- H2O2 + 2 ZnCl + 2 H+ → 2 H2O + 2 ZnCl2
- Existe una anomalía en el número de cloros. Se puede suponer que realmente los iones H+ han sido suministrados por dos moléculas de HCl, con lo que todo queda correcto:
- H2O2 + 2 ZnCl + 2 HCl → 2 H2O + 2 ZnCl2
Un ejemplo más: Cuando el sulfito potásico reacciona con permanganato potásico (en medio alcalino) se produce sulfato potásico y bióxido de manganeso. Balancear la ecuación química correspondiente.
- El proceso es... K2SO3 + KMnO4 → K2SO4 + MnO2
Y después de estudiar la ecuación decidimos escribirla de esta forma:
- (SO3)= + (MnO4)- → (SO4)= + MnO2
ya que el ión potásico no cambia su NO y además el MnO2 es covalente.
- Calculamos los NO...
- El azufre S pasa de +4 a +6 y el manganeso Mn pasa de +7 a +4. Y esto se expresa así:
- (S+4O3)= → (S+6O4)=
- (Mn+7O4)- → Mn+4O2
- Como los átomos de S y de Mn están igulados, pasaremos a ajustar los cambios de NO:
- (S+4O3)= → (S+6O4)= + 2 e-...............................OXIDACION
- (Mn+7O4)- + 3 e- → Mn+4O2....................REDUCCION
- Podemos decir que los iones sulfito (¡en medio básico!) reducen al permanganato (ó que el permanganato oxida a los sulfitos)
- Ajustamos las cargas eléctricas (¡en medio básico!)...
- (SO3)= + 2 (OH)- → (SO4)= + 2 e-
- (MnO4)- + 3 e- → MnO2 + 4 (OH)-
- Bueno, ya estamos terminando; equilibramos la cantidad de H...
- (SO3)= + 2 (OH)- → (SO4)= + 2 e- + H2O
- (MnO4)- + 3 e- + 2 H2O → MnO2 + 4 (OH)-
- Y ahora, para sumar y simplificar, multiplicamos la semirreacción superior por 3 y la de abajo por 2:
- 3 (SO3)= + 6 (OH)- → 3 (SO4)= + 6 e- + 3 H2O
- 2 (MnO4)- + 6 e- + 4 H2O → 2 MnO2 + 8 (OH)-
- Con todo lo cual se queda así:
- 3 (SO3)= + 2 (MnO4)- + H2O → 3 (SO4)= + 2 MnO2 + 2 (OH)-
- La ecuación ya está balanceada, pero puede interesarnos escribirla de este modo:
- 3 SO3K2 + 2 MnO4K + H2O → 3 SO4K2 + 2 MnO2 + 2 (OH)-
- y observamos que hay una disparidad en el número de K. Bien, podemos pensar que la base utilizada ha sido hidróxido potásico, pero que aparece en el 2º miembro de la ecuación:
- 3 SO3K2 + 2 MnO4K + H2O → 3 SO4K2 + 2 MnO2 + 2 K(OH)
Para terminar, proponemos el ajuste de estas ecuaciones redox:
- (Cr2O7)= + I- +H+ → Cr+++ + I2
- HCl + SnCl2 + H2O2 → SnCl4 + H2
Antes de iniciar el balance se tiene en cuenta lo siguiente:
- Determinar los diferentes numeros de oxidacion que hay en la ecuacion (tanto en los reactivos como en el producto)
- En la mayoria de casos el Hidrogeno cuenta con +1 exceptuando los hidruros donde trabaja con -1
- El oxigeno cuenta con -2 excepto cuando forma peroxidos (-1) y superoxidos (-1/2)
- Los elementos en estado basal (es decir sin ninguna relación con otro elemento tendra carga de 0)
Cuando ya se tengan los numeros de oxidacion se realiza el siguiente proceso:
1)Comparamos cada elemento tanto en los reactivos como en el resultado y verificamos los cambios.
Fe0+O2→Fe2+3O2-2- Es decir, en la formula tenemos que: El Hierro (Fe) esta en estado basal por tanto esta en 0, al finalizar la formula queda con +3 mientras que el oxigeno tendra 0 como reactivo y en el compuesto conseguira -2. Esto significa que el Hierro se oxida mientras que el Oxigeno se reduce
2)Si el elemento como reactivo esta en estado basal (es decir con carga 0) se multiplica el numero de oxidacion o reduccion por el subíndice.
Fe= 3(estado de oxidacion)X 1(subíndice)=3 O=2(estado de oxidacion)X 2(subíndice)=4Los resultados obtenidos se entrecruzan, es decir, si el resultado del Oxigeno es 4, pasara a hacer de coeficiente para Fe.
4Fe+3O2
TAREAESCRIBA LOS MÉTODOS DE IGUALAR ECUACIONES QUÍMICAS CON UN EJEMPLO PRACTICO PALNYTEADO POR USTED