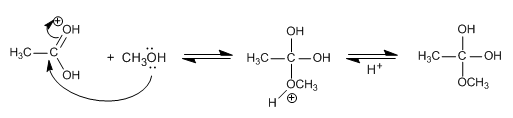
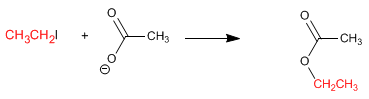
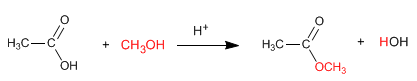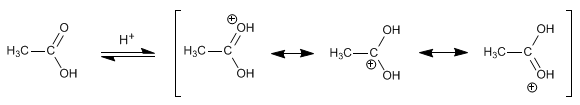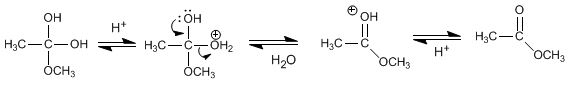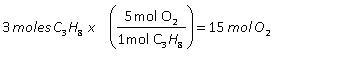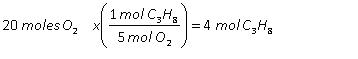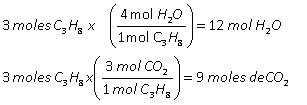Reglas de nutrición que potenciarán tu entrenamiento
Lo que comes y cuándo lo comes tiene un gran impacto en tu nivel de energía y en lo bien que te recuperas de un entrenamiento.
Escrito por el personal de Mayo ClinicTu cuerpo es una máquina. Y, como todas las máquinas, necesita el combustible adecuado para funcionar bien, especialmente si tú estás activo. Pero, ¿qué alimentos debes comer para potenciar tu entrenamiento? ¿Y cuándo?
Regla N.° 1: Prestar atención
Te sorprenderá ver cuántos adultos activos subestiman la importancia de alimentarse bien y por eso no ingieren los nutrientes clave.
No obtener suficientes vitaminas, minerales y otros nutrientes puede comprometer la salud y el rendimiento.
Sin embargo, es tan fácil como seguir las reglas conocidas para llevar una dieta saludable: comer muchas frutas y verduras, consumir proteínas magras, comer grasas saludables, consumir carbohidratos de granos integrales y beber mucho líquido, especialmente agua.
Regla N.º 2: Recarga energías (incluso si tu meta es bajar de peso)
Dale a tu cuerpo la energía que necesita para hacer el trabajo que deseas, incluso si estás tratando de bajar de peso.
Escatimar en alimentación puede reducir la masa muscular, disminuir la densidad ósea y producir fatiga. Esto te pone en riesgo de sufrir lesiones y enfermedades, aumenta el tiempo de recuperación, genera problemas hormonales y, en el caso de las mujeres, problemas menstruales.
Asegúrate de que tu plan de dieta proporcione suficientes calorías ricas en nutrientes para que puedas hacer ejercicio y mantenerte saludable y sin lesiones.
Regla N.º 3: Ama los carbohidratos (los necesitas)
Los carbohidratos tienen mala reputación con algunas personas. Pero las investigaciones de los últimos 50 años han demostrado que los carbohidratos ayudan al cuerpo durante los ejercicios largos y de alta intensidad. De hecho, mientras más activo seas, más carbohidratos necesitas.
Pero, ¿qué pasa con la tendencia de los atletas a comer dietas altas en grasa y bajas en carbohidratos? La evidencia sugiere que estas dietas no estimulan el desempeño atlético y en realidad lo obstaculizan a mayores intensidades.
Durante un entrenamiento, los carbohidratos alimentan el cerebro y los músculos.
- Carbohidratos para el entrenamiento promedio: si estás en buena forma y quieres alimentar un entrenamiento diario de intensidad ligera, coma alrededor de 3 a 5 gramos de carbohidratos por cada kilogramo de peso corporal. Para alguien que pesa 150 libras (68 kilogramos), eso es entre 200 y 340 gramos al día.
- Carbohidratos para entrenamientos más largos: si haces ejercicio más de una hora al día, puede necesitar de 6 a 10 gramos de carbohidratos por kilogramo de peso corporal. Para una persona de 150 libras, eso es de 408 a 680 gramos al día.
Escoge carbohidratos saludables como arroz integral, quinua, pan y pasta integral, batatas, frutas y verduras.
Regla N.° 4: Reconstruir con proteína
La proteína es importante porque proporciona los aminoácidos que tu cuerpo necesita para construir y reparar los músculos.
La mayoría de las investigaciones sugieren que las personas muy activas deben ingerir de 1.2 a 2 gramos de proteína por kilogramo de peso corporal. Eso significa que una persona de 150 libras debe comer de 82 a 136 gramos por día. Las personas que no son activas deben ingerir menos proteína. Intenta alcanzar los 0,8 gramos por kilogramo de peso corporal por día.
Las aves de corral (25 gramos en 3 onzas) y el pescado (20 gramos en 3 onzas) son buenas fuentes de proteína. Aquellos que prefieren evitar la carne pueden probar la soja (20 gramos por taza) y las legumbres como los frijoles, los cacahuetes y los garbanzos (unos 15 gramos por taza). Los huevos, el yogurt griego, el queso y el tofu también son ricos en proteína.
Regla N.° 5: No ignores las grasas
Las grasas son un tema confuso para muchas personas. Pero es esencial para una dieta saludable. La grasa proporciona energía y ayuda al cuerpo a absorber las vitaminas. Algunas vitaminas (como A, D, E y K) en realidad necesitan grasa para que le sirvan al cuerpo.
Asegúrate de elegir las grasas no saturadas. Las buenas fuentes son el aguacate, los aceites de oliva y canola, la linaza y los frutos secos.
Regla N.º 6: Saber qué necesitas antes del entrenamiento
Si haces ejercicio durante menos de una hora por vez, comer durante todo el día te daría suficiente energía. Sin embargo, para evitar problemas gastrointestinales, evita comer inmediatamente antes de hacer ejercicio.
Como regla general, come de una a tres horas antes del entrenamiento, incluso si vas a realizar una actividad sostenida de alta intensidad, como media maratón.
Regla N.º 7: Recuerda el posentrenamiento 15
Durante un entrenamiento, el cuerpo utiliza la energía almacenada. Después de hacer ejercicio, necesita restaurar esos nutrientes lo más rápido sea posible.
Las investigaciones sugieren que comer alimentos ricos en proteínas después del ejercicio (dentro de los 15 minutos siguientes) proporciona aminoácidos esenciales que construyen y reparan los músculos. Esto también puede aumentar la energía que almacena el cuerpo para utilizar en el futuro.
También es conveniente reponer los carbohidratos y líquidos después de un entrenamiento. Una estrategia consiste en beber un batido después del entrenamiento.
PROYECTO
REALICE UN COLLAGE O UN MAPA CONCEPTUAL SOBRE LA ALIMENTACIÓN SALUDABLE