Hidróxidos o bases
Definición de Hidróxidos o bases
Aunque son compuestos ternarios formados por la combinación de un metal, el oxígeno y el hidrógeno se pueden considerar como combinaciones de los cationes metálicos con tantos grupo hidroxilo (OH-) como indica el número de oxidación del metal.
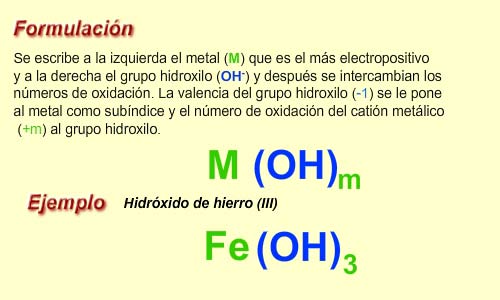
![]() Recuerda que los subíndices además de indicar las valencias también nos dicen el número de átomos de cada elemento que forman parte de la molécula.
Recuerda que los subíndices además de indicar las valencias también nos dicen el número de átomos de cada elemento que forman parte de la molécula.
Nomenclatura de los hidróxidos
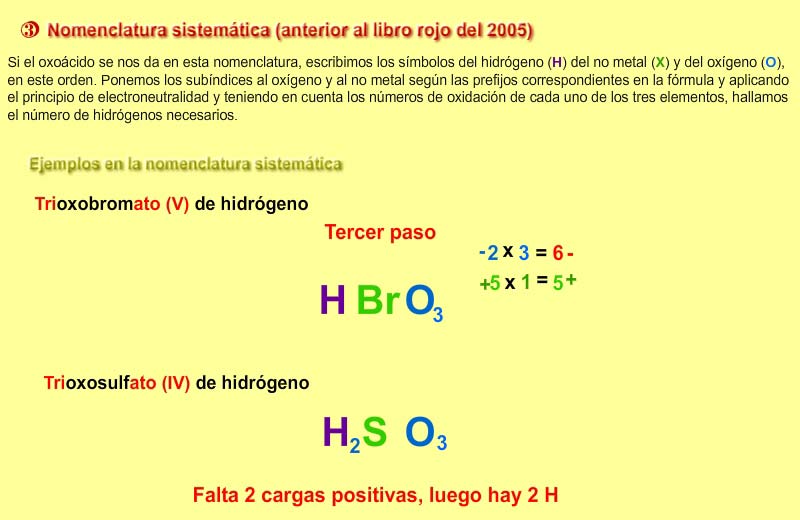
1) Sistemática: Se nombran con la palabra genérica hidróxido precedida de los prefijos multiplicativos -di, -tri, -tetra, etc. que indican el número de grupos hidroxilo (OH-) (si el catión metálico presenta varios estados de oxidación), la preposición de y el nombre del metal.
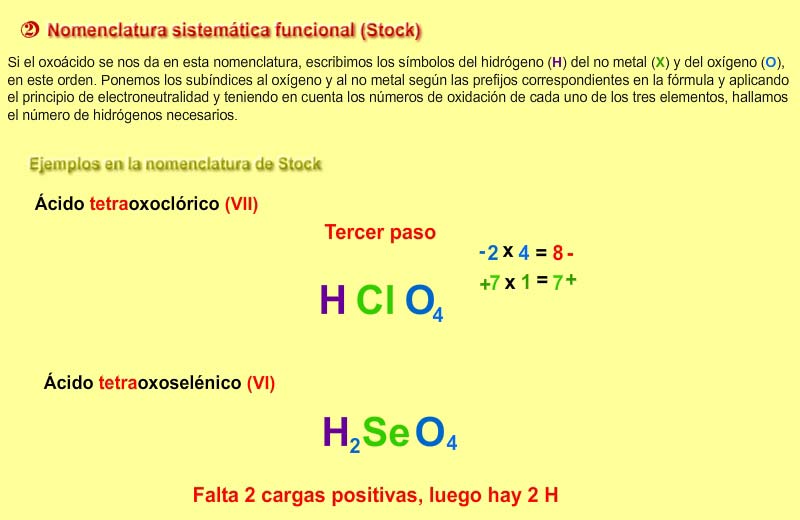
2) Stock: Es la nomenclatura recomendada por la IUPAC. Se nombran con las palabras “hidróxido de” seguido del nombre del metal y entre paréntesis el número de oxidación, en números romanos, si tiene más de uno.
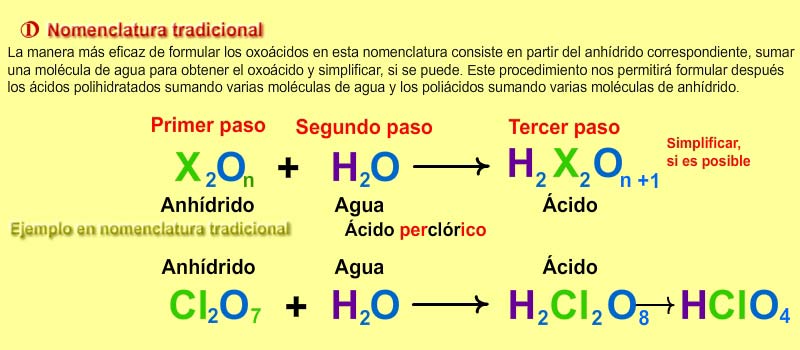
3) Tradicional: No está recomendada pero la usaremos como entrenamiento. Se nombran con las palabras “hidróxido de” seguido del nombre del metal terminada en los sufijos -oso u -ico según que actúe con la menor valencia o la mayor.
Ejemplos de hidróxidos o bases | |||
Compuesto | Sistemática | Stock (recomendada) | Tradicional (no recomendada) |
Cu(OH)3 | Dihidróxido de cobre | Hidróxido de cobre (II) | Hidróxido cúprico |
Ca(OH)2 | Hidróxido de calcio | Hidróxido de calcio | Hidróxido cálcico |
NH4OH | Hidróxido de amonio | Hidróxido de amonio | Hidróxido amónico |
Fe(OH)3 | Trihidróxido de hierro | Hidróxido de hierro (III) | Hidróxido férrico |
AuOH | Monohidróxido de oro | Hidróxido de oro (I) | Hidróxido auroso |
TAREA
ESCRIBA LA FORMACIÓN Y SU NOIMENCLATURA EN SU CUADERNO