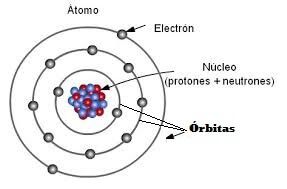
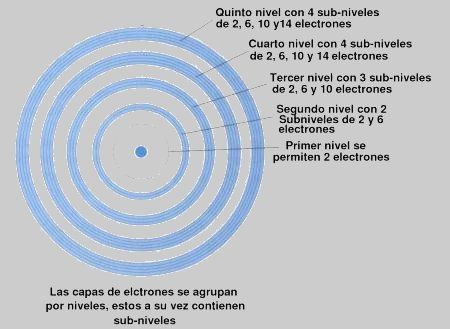
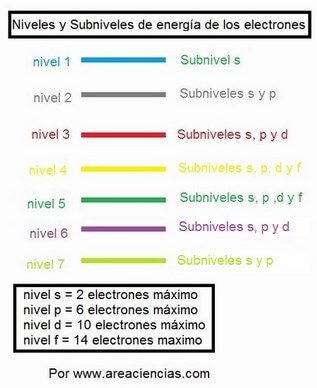
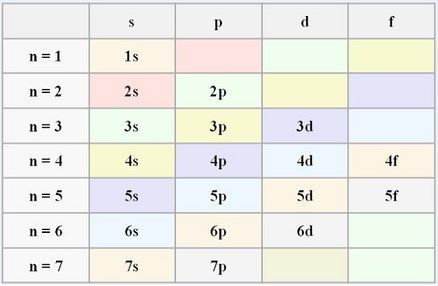
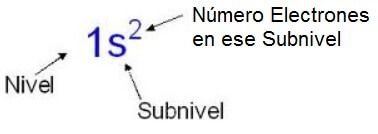
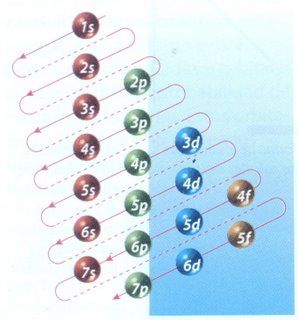
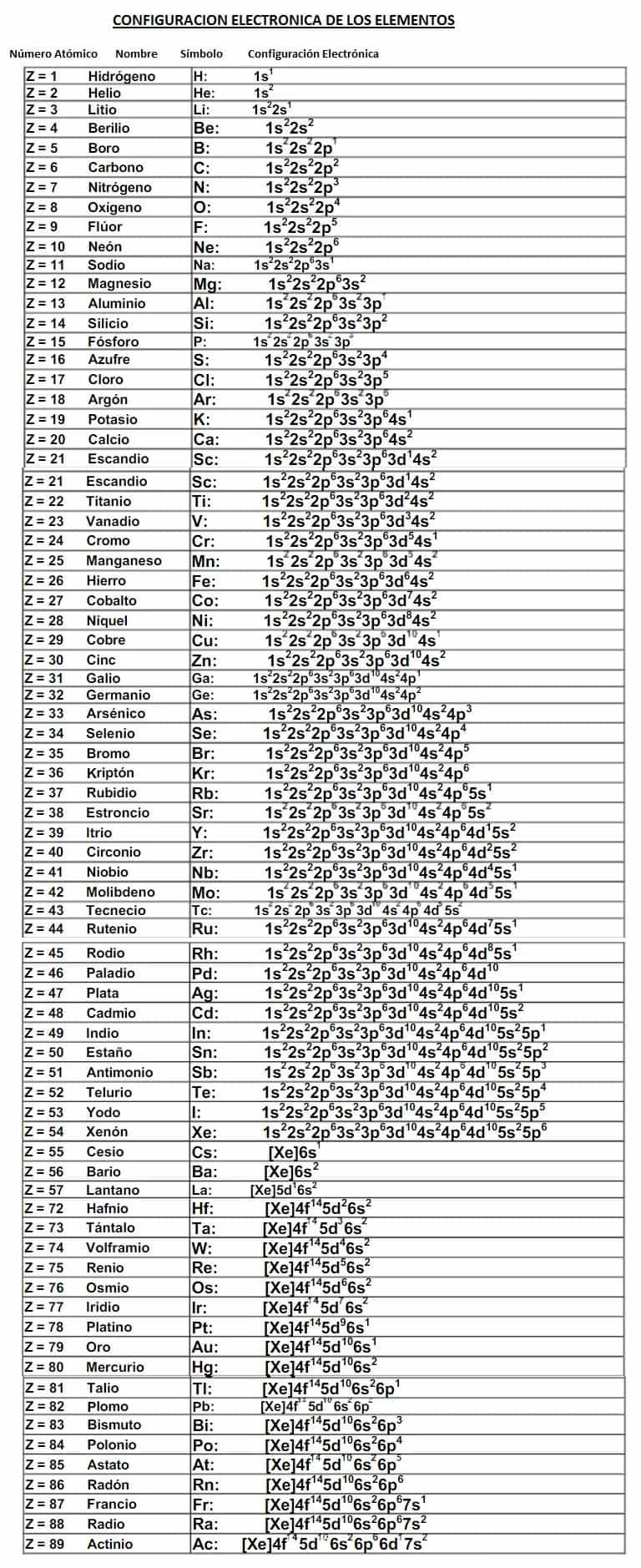
Uniones Químicas.
En química vemos dos tipos de uniones químicas. Las interatómicas y las intermoleculares.
Uniones Interatómicas: Son las que se establecen entre los átomos. Hay de tres tipos. En dos de ellas, las llamadas Iónicas y
Covalentes, los átomos tratan de llegar a completar el último nivel con
ocho electrones cumpliendo con la clásica teoría del octeto de Lewis.
La otra es la Unión metálica que se establece entre átomos iguales del
mismo metal.
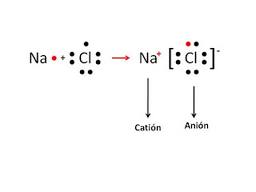
Uniones Iónicas: Aquellas que se realizan entre metales y no metales. Donde la diferencia de electronegatividad es importante. Ejemplos típicos lo constituyen los metales del grupo 1 o 2 con los no metales del grupo 7. Ej: Sodio con Cloro o Calcio con Bromo.
En estas uniones los electrones no se comparten sino que se ceden y se captan de forma absoluta, es decir, los metales electropositivos ceden electrones adquiriendo cargas positivas por tener protones en exceso. Y los no metales electronegativos los aceptan y completan así su último nivel energético. Se forman así cationes positivos y aniones negativos
P
ropiedades:
Las propiedades que distinguen a los compuestos iónicos son:
*Tener puntos de fusión y ebullición elevados.
*Ser solubles en solventes polares como el agua.
*Forman estructuras de redes cristalinas duras.
*Presentan alta conductividad eléctrica en soluciones acuosas por ser iones
Este tipo de estructuras representadas con los electrones de la última capa, se denominan estructuras de Lewis. También las usaremos para las uniones covalentes.
Otro ejemplo: El Calcio, del grupo 2, se une con otro del grupo 7, en este caso el Yodo. Los 2 electrones del calcio son cedidos a los dos átomos de Yodo, que tienen 7 electrones en su último nivel. Llegando de esta forma al octeto propuesto por Lewis.
Antes de continuar con las uniones covalentes te dejo el video de uniones iónicas para que no te quedes con dudas.
<span data-mce-type="bookmark" style="display: inline-block; width: 0px; overflow: hidden; line-height: 0;" class="mce_SELRES_start"></span>
Uniones Covalentes:
En este tipo de unión los no metales se unen con los no metales. Se da entre los átomos con poca o nula diferencia de electronegatividad. Y a diferencia de las uniones iónicas no se forman iones. Las uniones se establecen por la formación de pares electrónicos, de los cuales, cada electrón del par es aportado por uno de los átomos que forman dichas uniones. Los electrones se comparten, no se ceden o se captan totalmente. Esta es otra gran diferencia con respecto a la unión iónica en donde los electrones se ceden totalmente de parte de los cationes.
Algunas características que presentan los compuestos covalentes son:
Presentar bajos puntos de fusión y ebullición
Ser insolubles en solventes polares como el agua y el alcohol.
Ser solubles en ciertos solventes orgánicos
No formar iones
Aquí vemos un ejemplo de una unión covalente entre el oxigeno y el carbono. Podemos ver la formación de dos pares dobles de electrones, ya que cada unión está formada por cuatro electrones en total. Dos de ellos los aporta el carbono y los otros dos el oxígeno. Tanto el carbono como el oxígeno llegan a ocho electrones en total.
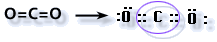
Otro ejemplo lo constituye la unión entre el oxigeno y el azufre. En este caso se da entre estos un tipo de unión covalente algo distinta. Ya que como observamos, el azufre le presta dos electrones al oxígeno, es decir, que el par electrónico esta vez está constituido por el aporte de un solo átomo en lugar de dos átomos como de costumbre. Este tipo de unión se llama covalente dativa porque un solo átomo es el portador del par electrónico. También se la llama covalente coordinada. Cabe destacar que si bien el par es cedido por uno de los dos átomos, este no lo pierde sino que lo presta. La otra unión en la parte lateral del esquema es una unión covalente doble común.
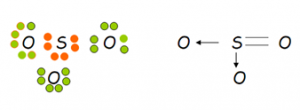
Cuando dos elementos se unen en la unión covalente se da otro fenómeno que merece también ser considerado. Si bien no son uniones iónicas y no veremos la formación de iones con sus cargas expuestas, al existir diferencia de electronegatividad cuando son distintos, el par electrónico queda más cerca del elemento más electronegativo.
Un ejemplo lo constituye la unión entre el cloro y el hidrógeno.
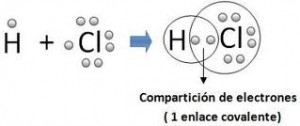
El par electrónico formado por dos electrones aportados uno por cada átomo esta muchos más inclinado hacia el cloro que es el elemento más electronegativo en este ejemplo.
Obviamente que si se trata de una unión en la que ambos tienen la misma electronegatividad el o los pares electrónicos estarán ubicados en el medio o en la zona central de los núcleos atómicos. Como ejemplos podemos citar a las moléculas biatómicas de oxígeno, hidrógeno, nitrógeno, etc.
Acido Sulfúrico:
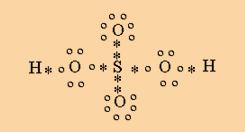
Aquí vemos dos uniones covalentes dativas entre el átomo de azufre y los dos oxígenos que estan por encima y por debajo del azufre (dos asteriscos negros). El resto son uniones covalentes simples y comunes.
Veremos un ejemplo más de unión covalente. Esta vez con tres átomos distintos. Representaremos a la molécula de ácido nítrico. (HNO3).
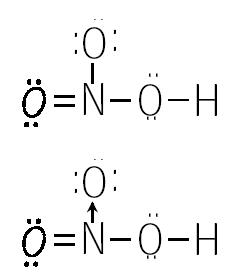
Observamos que el átomo de nitrógeno aporta un par electrónico o sea una unión dativa entre el nitrógeno y el átomo superior de oxígeno.
Tenemos una unión covalente simple entre el nitrógeno y el oxigeno, otra covalente doble entre estos mismos átomos y una covalente dativa desde el nitrógeno al otro oxígeno.
Antes de comenzar con unión Metálica te dejo el video de Uniones Covalentes. No te lo pierdas.
<span data-mce-type="bookmark" style="display: inline-block; width: 0px; overflow: hidden; line-height: 0;" class="mce_SELRES_start"></span>
Unión Metálica:
En las uniones metálicas, los átomos se mantienen unidos gracias a que sus núcleos positivos están rodeados de una nube de electrones en permanente movimiento. Adquieren una forma de red tridimensional donde los nudos están representados por los núcleos atómicos y estos están rodeados por otros. Esta característica es la responsable de algunas propiedades de los metales como ser excelentes conductores de la electricidad y tener cierto brillo.
A continuación vamos a desarrollar un tema que nos sirve para entender la polaridad de las moléculas covalentes. Geometría Molecular y Geometría electrónica.
Cuando analizamos algunas moléculas y llegamos a la conclusión de que son polares debemos analizar las causas.
Debemos comentar básicamente la Teoría de la repulsión de los pares electrónicos de valencia.
Esta teoría establece que los pares electrónicos compartidos entre átomos y los no compartidos guardan entre si la máxima distancia posible por la repulsión entre cargas negativas. Si por ejemplo estamos en presencia de solo dos pares electrónicos estos se separaran unos 180°. Si tenemos tres pares en total, se separaran formando 120° de separación entre sí y así sucesivamente. Esto ayuda a establecer la geometría molecular y electrónica que tendrán los compuestos covalentes en el espacio.
Lo que determina que un compuesto sea polar es la magnitud de una cantidad vectorial llamada momento dipolar. Cada átomo que se une con otro distinto determina un momento dipolar. La suma de los distintos momentos de cada enlace entre el par de átomos va a dar como resultado el momento dipolar resultante de la molécula. Si la resultante da cero, concluiremos que la molécula será no polar, así no sean cero los momentos individuales. Esto sucede porque los momentos se anulan entre sí por ser de igual intensidad y de sentido contrario. La geometría molecular y electrónica como vemos es un factor trascendental.
Es bueno entender la diferencia entre las dos geometrías. Cuando hablamos de G.E. nos referimos a la disposición espacial que toman todos los pares electrónicos, los compartidos y los no compartidos. En cambio en la G.M. se refiere a la disposición que forman los pares electrónicos de enlace, sin tener en cuenta a los pares de electrones no compartidos.
Por ejemplo.
En el CO2, el carbono se halla unido a dos átomos de oxígeno. Los dos momentos dipolares se dirigen vectorialmente hacia los átomos de oxígeno ya que son más electronegativos que el de carbono. Estos vectores son de igual magnitud pero de distinto sentido por lo tanto se anulan al formar un ángulo de 180°. La molécula CO2 resulta ser no polar. La G.M. coincide en este caso con la G.E. ya que no hay electrones no compartidos. Esta geometría es lineal.
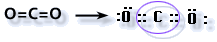
O ← C → O
En el caso del agua, como se vio anteriormente. Podemos ver que hay cuatro pares de electrones, dos compartidos y otros dos no compartidos pertenecientes al oxigeno. La máxima repulsión entre estos cuatro pares en total genera una geometría electrónica tetraédrica.
El ángulo máximo de separación en estos casos es de unos 109 grados aprox. Es el ángulo que hay entre los dos átomos de hidrógeno. Los dos dipolos que hay entre los átomos de hidrogeno y el de oxigeno apuntan hacia el oxigeno que es el elemento más electronegativo. Por lo tanto no se eliminan. Esto hace que la molécula de agua sea polar.
Aquí hay una diferencia entre las dos geometrías. La G.E. es tetraédrica, pero la G.M. es angular ya que se consideran solo a los dos enlaces O-H.
Otro caso es el del H2S.
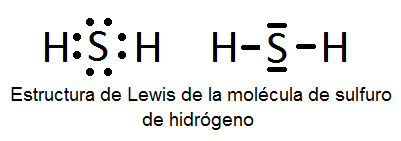
Cada línea representa un par electrónico. Hay dos entre el azufre y cada hidrógeno y otros dos pares sin compartir del azufre que ocupan un importente espacio y hace que cambie la forma d ela molécula adquiriendo una forma de tetrahedro.
Los pares compartidos son dipolos con el sentido hacia el azufre.

La geometría electrónica (G.M.) está representada por un tetraedro y la geometría molecular (G.M.) es angular. En este caso hablamos de unos 109° aprox. Algo menor que el agua. Esto sucede porque los pares electrónicos libres que no forman enlaces ocupan un poco más de espacio que en el oxígeno.
En el caso del amoníaco (NH3), el nitrógeno tiene tres enlaces con los hidrógenos formando tres dipolos orientados hacia el nitrógeno. Tiene otro par electrónico sin compartir. Por lo tanto deducimos que si hay cuatro pares de electrones en total, la G.E. será tetraédrica. La G.M. es trigonal piramidal. El ángulo de enlace es algo mayor que el del agua y sulfuro de hidrogeno por tener solamente un par no compartido de electrones en lugar de dos, ocupando menos espacio. Hablamos de un ángulo de 107° algo mayor que los 104.5° que hay en el H2O y el H2S.
Uniones intermoleculares:
Son más débiles que las interatómicas. Podemos clasificar a las uniones intermoleculares en tres tipos.
Unión Puente de Hidrogeno y Fuerzas de Van der Waals. Dentro de estas últimas tenemos Las fuerzas de dispersión o de London, y las interacciones dipolo-dipolo o dipolo-dipolo inducido.
Puente de Hidrógeno: Es la más fuerte de las intermoleculares y es la responsable del alto punto de ebullición que exhiben moléculas como el agua. Se da mucho en aquellas moléculas que tienen átomos de hidrógeno. El ejemplo más común es la molécula de agua. (H2O). Representemos primero le estructura electrónica de esta molécula.
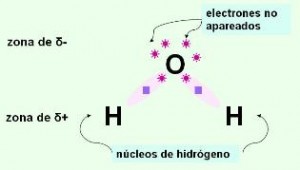
Observamos que el átomo de oxígeno tiene dos pares de electrones sin compartir y que además los dos pares electrónicos que forma con los hidrógenos están más cercanos al oxígeno. Estas circunstancias convierten al oxígeno en un átomo con una densidad de carga considerablemente negativa así como una densidad de carga positiva rodeara a los átomos de hidrógeno.
Esto generará atracciones con moléculas vecinas de agua formando una enorme red asociada. Las uniones se establecerán entre átomos de hidrógeno de unas moléculas con átomos de oxígeno de otras.
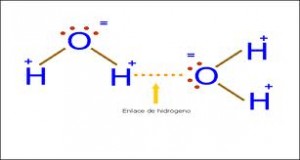
También otras moléculas que tienen este tipo de unión son por ejemplo HCl, H2S, y los alcoholes ya que poseen el grupo oxhidrilo (OH–).
Fuerzas de Van der Waals.
Las fuerzas de Van der Waals son fuerzas menos fuertes que las de puente de hidrógeno. Su naturaleza es eléctrica y aparece como consecuencia de la aparición de dipolos permanentes o transitorios en moléculas vecinas. En las de dipolo permanente cada molécula constituye un dipolo y su parte positiva se une con la parte negativa de la molécula vecina. Es decir, que este tipo de unión se da solo en las moléculas polares. En las uniones de dipolo transitorio, cada molécula es un dipolo por un período muy corto de tiempo. Estas uniones también se conocen como fuerzas de London. No son moléculas polares por tener una distribución electrónica muy simétrica alrededor del núcleo atómico. Sin embargo, en algunas circunstancias, estas moléculas pueden cambiar su distribución simétrica por algún choque contra el recipiente o con moléculas vecinas apareciendo los dipolos momentáneos y las interacciones con moléculas vecinas. Cabe aclarar que las fuerzas de London existen también en todas las moléculas polares ya que estas igual experimentan corrimientos en sus nubes electrónicas. Pero en las moléculas no polares son las únicas fuerzas intermoleculares que existen.
En otras ocasiones se pueden generar también dipolos inducidos por la aproximación de una molécula polar hacia otra no polar. La polar inducirá un dipolo en la molécula no polar.
Uniones Iónicas: Aquellas que se realizan entre metales y no metales. Donde la diferencia de electronegatividad es importante. Ejemplos típicos lo constituyen los metales del grupo 1 o 2 con los no metales del grupo 7. Ej: Sodio con Cloro o Calcio con Bromo.
En estas uniones los electrones no se comparten sino que se ceden y se captan de forma absoluta, es decir, los metales electropositivos ceden electrones adquiriendo cargas positivas por tener protones en exceso. Y los no metales electronegativos los aceptan y completan así su último nivel energético. Se forman así cationes positivos y aniones negativos
P
ropiedades:
Las propiedades que distinguen a los compuestos iónicos son:
*Tener puntos de fusión y ebullición elevados.
*Ser solubles en solventes polares como el agua.
*Forman estructuras de redes cristalinas duras.
*Presentan alta conductividad eléctrica en soluciones acuosas por ser iones

Este tipo de estructuras representadas con los electrones de la última capa, se denominan estructuras de Lewis. También las usaremos para las uniones covalentes.
Otro ejemplo: El Calcio, del grupo 2, se une con otro del grupo 7, en este caso el Yodo. Los 2 electrones del calcio son cedidos a los dos átomos de Yodo, que tienen 7 electrones en su último nivel. Llegando de esta forma al octeto propuesto por Lewis.
Antes de continuar con las uniones covalentes te dejo el video de uniones iónicas para que no te quedes con dudas.
<span data-mce-type="bookmark" style="display: inline-block; width: 0px; overflow: hidden; line-height: 0;" class="mce_SELRES_start"></span>
Uniones Covalentes:
En este tipo de unión los no metales se unen con los no metales. Se da entre los átomos con poca o nula diferencia de electronegatividad. Y a diferencia de las uniones iónicas no se forman iones. Las uniones se establecen por la formación de pares electrónicos, de los cuales, cada electrón del par es aportado por uno de los átomos que forman dichas uniones. Los electrones se comparten, no se ceden o se captan totalmente. Esta es otra gran diferencia con respecto a la unión iónica en donde los electrones se ceden totalmente de parte de los cationes.
Algunas características que presentan los compuestos covalentes son:
Presentar bajos puntos de fusión y ebullición
Ser insolubles en solventes polares como el agua y el alcohol.
Ser solubles en ciertos solventes orgánicos
No formar iones
Aquí vemos un ejemplo de una unión covalente entre el oxigeno y el carbono. Podemos ver la formación de dos pares dobles de electrones, ya que cada unión está formada por cuatro electrones en total. Dos de ellos los aporta el carbono y los otros dos el oxígeno. Tanto el carbono como el oxígeno llegan a ocho electrones en total.
Otro ejemplo lo constituye la unión entre el oxigeno y el azufre. En este caso se da entre estos un tipo de unión covalente algo distinta. Ya que como observamos, el azufre le presta dos electrones al oxígeno, es decir, que el par electrónico esta vez está constituido por el aporte de un solo átomo en lugar de dos átomos como de costumbre. Este tipo de unión se llama covalente dativa porque un solo átomo es el portador del par electrónico. También se la llama covalente coordinada. Cabe destacar que si bien el par es cedido por uno de los dos átomos, este no lo pierde sino que lo presta. La otra unión en la parte lateral del esquema es una unión covalente doble común.
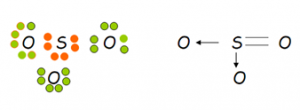
Cuando dos elementos se unen en la unión covalente se da otro fenómeno que merece también ser considerado. Si bien no son uniones iónicas y no veremos la formación de iones con sus cargas expuestas, al existir diferencia de electronegatividad cuando son distintos, el par electrónico queda más cerca del elemento más electronegativo.
Un ejemplo lo constituye la unión entre el cloro y el hidrógeno.

El par electrónico formado por dos electrones aportados uno por cada átomo esta muchos más inclinado hacia el cloro que es el elemento más electronegativo en este ejemplo.
Obviamente que si se trata de una unión en la que ambos tienen la misma electronegatividad el o los pares electrónicos estarán ubicados en el medio o en la zona central de los núcleos atómicos. Como ejemplos podemos citar a las moléculas biatómicas de oxígeno, hidrógeno, nitrógeno, etc.
Acido Sulfúrico:

Aquí vemos dos uniones covalentes dativas entre el átomo de azufre y los dos oxígenos que estan por encima y por debajo del azufre (dos asteriscos negros). El resto son uniones covalentes simples y comunes.
Veremos un ejemplo más de unión covalente. Esta vez con tres átomos distintos. Representaremos a la molécula de ácido nítrico. (HNO3).

Observamos que el átomo de nitrógeno aporta un par electrónico o sea una unión dativa entre el nitrógeno y el átomo superior de oxígeno.
Tenemos una unión covalente simple entre el nitrógeno y el oxigeno, otra covalente doble entre estos mismos átomos y una covalente dativa desde el nitrógeno al otro oxígeno.
Antes de comenzar con unión Metálica te dejo el video de Uniones Covalentes. No te lo pierdas.
<span data-mce-type="bookmark" style="display: inline-block; width: 0px; overflow: hidden; line-height: 0;" class="mce_SELRES_start"></span>
Unión Metálica:
En las uniones metálicas, los átomos se mantienen unidos gracias a que sus núcleos positivos están rodeados de una nube de electrones en permanente movimiento. Adquieren una forma de red tridimensional donde los nudos están representados por los núcleos atómicos y estos están rodeados por otros. Esta característica es la responsable de algunas propiedades de los metales como ser excelentes conductores de la electricidad y tener cierto brillo.
A continuación vamos a desarrollar un tema que nos sirve para entender la polaridad de las moléculas covalentes. Geometría Molecular y Geometría electrónica.
Cuando analizamos algunas moléculas y llegamos a la conclusión de que son polares debemos analizar las causas.
Debemos comentar básicamente la Teoría de la repulsión de los pares electrónicos de valencia.
Esta teoría establece que los pares electrónicos compartidos entre átomos y los no compartidos guardan entre si la máxima distancia posible por la repulsión entre cargas negativas. Si por ejemplo estamos en presencia de solo dos pares electrónicos estos se separaran unos 180°. Si tenemos tres pares en total, se separaran formando 120° de separación entre sí y así sucesivamente. Esto ayuda a establecer la geometría molecular y electrónica que tendrán los compuestos covalentes en el espacio.
Lo que determina que un compuesto sea polar es la magnitud de una cantidad vectorial llamada momento dipolar. Cada átomo que se une con otro distinto determina un momento dipolar. La suma de los distintos momentos de cada enlace entre el par de átomos va a dar como resultado el momento dipolar resultante de la molécula. Si la resultante da cero, concluiremos que la molécula será no polar, así no sean cero los momentos individuales. Esto sucede porque los momentos se anulan entre sí por ser de igual intensidad y de sentido contrario. La geometría molecular y electrónica como vemos es un factor trascendental.
Es bueno entender la diferencia entre las dos geometrías. Cuando hablamos de G.E. nos referimos a la disposición espacial que toman todos los pares electrónicos, los compartidos y los no compartidos. En cambio en la G.M. se refiere a la disposición que forman los pares electrónicos de enlace, sin tener en cuenta a los pares de electrones no compartidos.
Por ejemplo.
En el CO2, el carbono se halla unido a dos átomos de oxígeno. Los dos momentos dipolares se dirigen vectorialmente hacia los átomos de oxígeno ya que son más electronegativos que el de carbono. Estos vectores son de igual magnitud pero de distinto sentido por lo tanto se anulan al formar un ángulo de 180°. La molécula CO2 resulta ser no polar. La G.M. coincide en este caso con la G.E. ya que no hay electrones no compartidos. Esta geometría es lineal.
O ← C → O
En el caso del agua, como se vio anteriormente. Podemos ver que hay cuatro pares de electrones, dos compartidos y otros dos no compartidos pertenecientes al oxigeno. La máxima repulsión entre estos cuatro pares en total genera una geometría electrónica tetraédrica.
El ángulo máximo de separación en estos casos es de unos 109 grados aprox. Es el ángulo que hay entre los dos átomos de hidrógeno. Los dos dipolos que hay entre los átomos de hidrogeno y el de oxigeno apuntan hacia el oxigeno que es el elemento más electronegativo. Por lo tanto no se eliminan. Esto hace que la molécula de agua sea polar.
Aquí hay una diferencia entre las dos geometrías. La G.E. es tetraédrica, pero la G.M. es angular ya que se consideran solo a los dos enlaces O-H.
Otro caso es el del H2S.

Cada línea representa un par electrónico. Hay dos entre el azufre y cada hidrógeno y otros dos pares sin compartir del azufre que ocupan un importente espacio y hace que cambie la forma d ela molécula adquiriendo una forma de tetrahedro.
Los pares compartidos son dipolos con el sentido hacia el azufre.

La geometría electrónica (G.M.) está representada por un tetraedro y la geometría molecular (G.M.) es angular. En este caso hablamos de unos 109° aprox. Algo menor que el agua. Esto sucede porque los pares electrónicos libres que no forman enlaces ocupan un poco más de espacio que en el oxígeno.
En el caso del amoníaco (NH3), el nitrógeno tiene tres enlaces con los hidrógenos formando tres dipolos orientados hacia el nitrógeno. Tiene otro par electrónico sin compartir. Por lo tanto deducimos que si hay cuatro pares de electrones en total, la G.E. será tetraédrica. La G.M. es trigonal piramidal. El ángulo de enlace es algo mayor que el del agua y sulfuro de hidrogeno por tener solamente un par no compartido de electrones en lugar de dos, ocupando menos espacio. Hablamos de un ángulo de 107° algo mayor que los 104.5° que hay en el H2O y el H2S.
Uniones intermoleculares:
Son más débiles que las interatómicas. Podemos clasificar a las uniones intermoleculares en tres tipos.
Unión Puente de Hidrogeno y Fuerzas de Van der Waals. Dentro de estas últimas tenemos Las fuerzas de dispersión o de London, y las interacciones dipolo-dipolo o dipolo-dipolo inducido.
Puente de Hidrógeno: Es la más fuerte de las intermoleculares y es la responsable del alto punto de ebullición que exhiben moléculas como el agua. Se da mucho en aquellas moléculas que tienen átomos de hidrógeno. El ejemplo más común es la molécula de agua. (H2O). Representemos primero le estructura electrónica de esta molécula.

Observamos que el átomo de oxígeno tiene dos pares de electrones sin compartir y que además los dos pares electrónicos que forma con los hidrógenos están más cercanos al oxígeno. Estas circunstancias convierten al oxígeno en un átomo con una densidad de carga considerablemente negativa así como una densidad de carga positiva rodeara a los átomos de hidrógeno.
Esto generará atracciones con moléculas vecinas de agua formando una enorme red asociada. Las uniones se establecerán entre átomos de hidrógeno de unas moléculas con átomos de oxígeno de otras.

También otras moléculas que tienen este tipo de unión son por ejemplo HCl, H2S, y los alcoholes ya que poseen el grupo oxhidrilo (OH–).
Fuerzas de Van der Waals.
Las fuerzas de Van der Waals son fuerzas menos fuertes que las de puente de hidrógeno. Su naturaleza es eléctrica y aparece como consecuencia de la aparición de dipolos permanentes o transitorios en moléculas vecinas. En las de dipolo permanente cada molécula constituye un dipolo y su parte positiva se une con la parte negativa de la molécula vecina. Es decir, que este tipo de unión se da solo en las moléculas polares. En las uniones de dipolo transitorio, cada molécula es un dipolo por un período muy corto de tiempo. Estas uniones también se conocen como fuerzas de London. No son moléculas polares por tener una distribución electrónica muy simétrica alrededor del núcleo atómico. Sin embargo, en algunas circunstancias, estas moléculas pueden cambiar su distribución simétrica por algún choque contra el recipiente o con moléculas vecinas apareciendo los dipolos momentáneos y las interacciones con moléculas vecinas. Cabe aclarar que las fuerzas de London existen también en todas las moléculas polares ya que estas igual experimentan corrimientos en sus nubes electrónicas. Pero en las moléculas no polares son las únicas fuerzas intermoleculares que existen.
En otras ocasiones se pueden generar también dipolos inducidos por la aproximación de una molécula polar hacia otra no polar. La polar inducirá un dipolo en la molécula no polar.