ÁCIDOS GRASOS
Introducción
Los ácidos grasos son ácidos orgánicos monoenoicos, que se encuentran presentes en las grasas, raramente libres, y casi siempre esterificando al glicerol y eventualmente a otros alcoholes. Son generalmente de cadena lineal y tienen un número par de átomos de carbono. La razón de esto es que en el metabolismo de los eucariotas, las cadenas de ácido graso se sintetizan y se degradan mediante la adición o eliminación de unidades de acetato. No obstante, hay excepciones, ya que se encuentran ácidos grasos de número impar de átomos de carbono en la leche y grasa de los rumiantes, procedentes del metabolismo bacteriano del rumen, y también en algunos lípidos de vegetales, que no son utilizados comunmente para la obtención de aceites.
Los ácidos grasos como tales (ácidos grasos libres) son poco frecuentes en los alimentos, y además son generalmente producto de la alteración lipolítica. Sin embargo, son constituyentes fundamentales de la gran mayoría de los lípidos, hasta el punto de que su presencia es casi definitoria de esta clase de sustancias.

El inicio de la química de las grasas se debe al químico francés Chevreul, que en las primeras décadas del siglo XIX caracterizo la estructura de los triglicéridos y de varios de los ácidos grasos más importantes.Ácidos grasos saturados
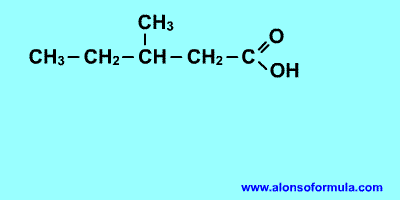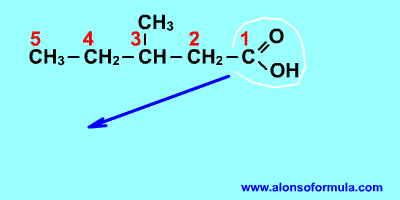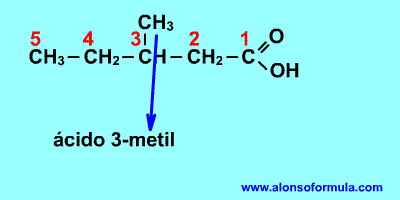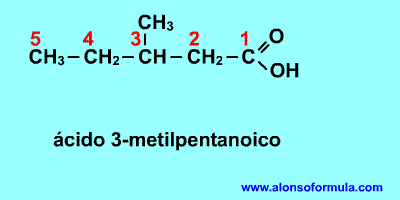
La longitud de la cadena va desde los cuatro carbonos del ácido butírico a los 35 del ácido ceroplástico. Si se considera un ácido graso al butírico y no al acético, es porque el primero es relativamente abundante en la grasa de la leche, mientras que el segundo no se encuentra en ninguna grasa natural conocida. Los ácidos grasos saturados más comunes son los de 14, 16 y 18 átomos de carbono. Dada su estructura, los ácidos grasos saturados son sustancias extremadamente estables desde el punto de vista químico.

Ácido butírico (4:0) Ácido laúrico (12:0) Ácido palmítico (16:0) ACIDOS GRASOS SATURADOS MAS COMUNES
| Estructura | Nombre común | Se encuentra en |
| C 4:0 | butírico | leche de rumiantes |
| C 6:0 | caproico | leche de rumiantes |
| C 8:0 | caprílico | leche de rumiantes, aceite de coco |
| C 10:0 | cáprico | leche de rumiantes, aceite de coco |
| C 12:0 | láurico | aceite de coco, aceite de nuez de palma |
| C 14:0 | mirístico | coco, nuez de palma, otros aceites vegetales |
| C 16:0 | palmítico | abundante en todas las grasas |
| C 18:0 | esteárico | grasas animales, cacao |
ácidos grasos insaturados
Los ácidos grasos insaturados tienen en la cadena dobles enlaces, en un número que va de 1 a 6. los que tienen una sóla insaturación se llaman monoinsaturados, quedando para el resto el término de poliinsaturados, aunque evidentemente también puede hablarse de diinsaturados, triinsaturados, etc.
En los ácidos grasos habituales, es decir, en la inmensa mayoría de los procedentes del metabolismo eucariota que no han sufrido un procesado o alteración químicos, los dobles enlaces están siempre en la configuración
cis.
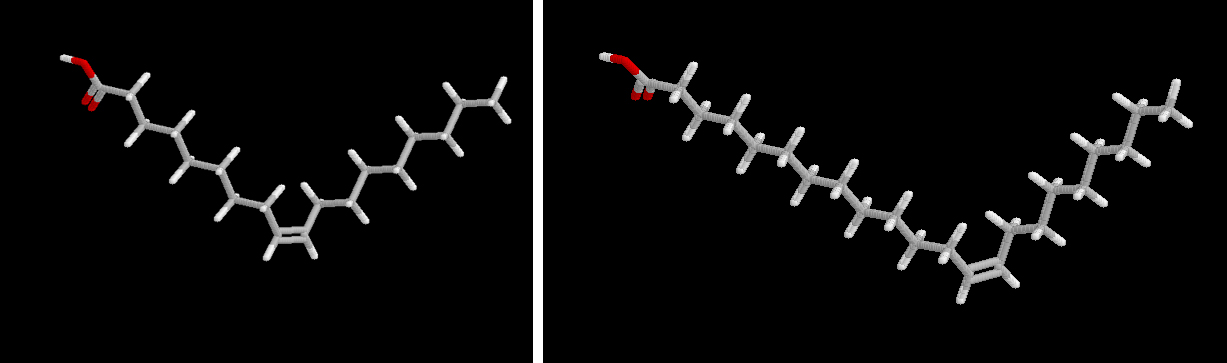
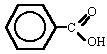
Ácido oleico (18:1 n-9) Ácido erúcico (22:1 n-9) Una cuestión de nomenclatura
Según las normas de la IUPAC, utilizadas de forma general, la cadena de los ácidos grasos se numera a partir del carbono del carboxilo, que es entonces el número 1. La posición de los dobles enlaces se indica utilizando la letra griega
D, delta mayúscula. Ahora bien, en las ramas científicas que consideran los ácidos grasos desde el punto de vista biológico y no puramente químico, se utiliza otra nomenclatura, numerado la cadena a aprtir del metilo. En este caso, la posición de los dobles enlaces se indica con la letra griega
w omega minúscula, o con la letra n. La razón es que en los seres vivos la elongación, insaturación y corte de los ácidos grasos se produce a partir del extremo carboxilo, por los que numerando desde el metilo se mantiene la relación entre los que pertenecen a la misma serie metabólica. Además, como en los ácidos grasos habituales, y especialmente en las series metabólicas correspondientes al linoleico y linolénico los dobles enlaces están situados siempre con un CH2 entre ellos, solamente se especifica la posición del primero (contando desde el metilo)
Por ejemplo, utilizando las normas de la IUPAC:
El ácido 18:2
D 9,12 se elonga para dar 20:2
D 11,14, que a su vez se puede insaturar para dar 20:3
D 5, 11, 14 o elongar hasta 24:2
D 15, 18.
Utilizando el sistema bioquímico:
El ácido 18:2 n-6 se elonga para dar 20:2 n-6 que a su vez se puede insaturar para dar 20:3 n-6, o elongar hasta 24:2 n-6. Es evidente cual de los dos sistemas es el más útil para el estudio del metabolismo.
ACIDOS GRASOS MONOINSATURADOS
| Estructura | Nombre común | Se encuentra en |
| C 10:1 n-1 | caproleico | leche de rumiantes |
| C 12:1 n-3 | lauroleico | leche de vaca |
| C 16:1 n-7 | palmitoleico | nuez de macadamia, aceites de pescado |
| C 18:1 n-9 | oleico | aceites vegetales (muy extendido en la naturaleza) |
| C 18:1 n-7 | vaccénico | grasas de rumiantes |
| C 20:1 n-11 | gadoleico | aceites de pescado |
| C 22:1 n-11 | cetoleico | aceites de pescado |
| C 22:1 n-9 | erúcico | aceite de colza |
ácidos grasos poliinsaturados y esenciales
Los ácidos grasos poliinsaturados más frecuentes pertenecen a las series n-6 y n-3, que tienen como cabezas respectivas al ácido linoleico (18:2 n-6) y al linolénico (18:3 n-3). Estos dos ácidos grasos son esenciales, es decir, no pueden sintetizarse en el organismo, y deben obtenerse de la dieta. Todos los demás ácidos grasos de sus series sí pueden obtenerse a partir de ellos.
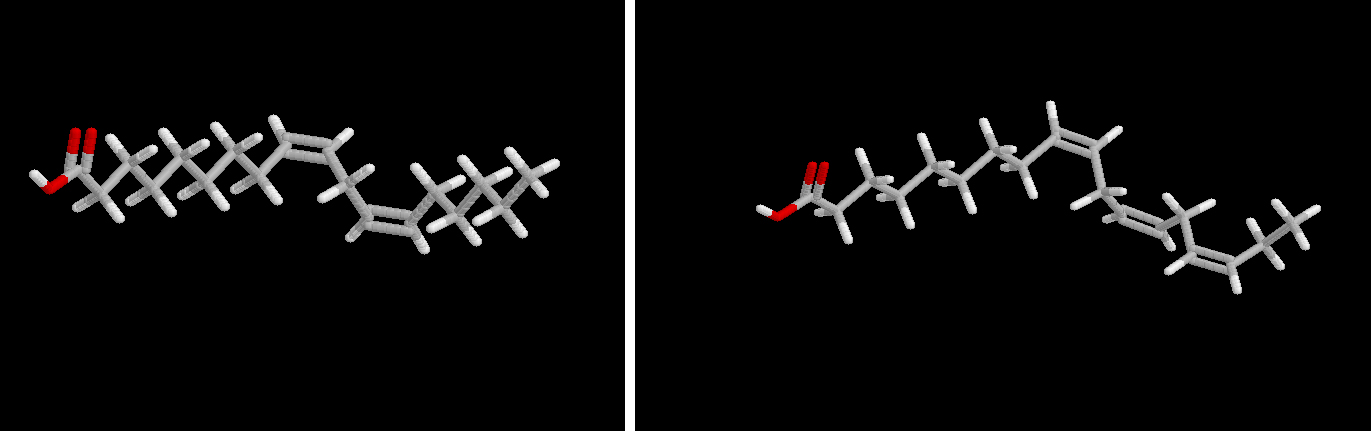
Ácido linoleico (18:1 n-9) Ácido linolénico (22:1 n-9) En todos los casos, los dobles enlaces se encuentran separados por un carbono, es decir, formando un sistema dieno no conjugado.
ACIDOS GRASOS POLIINSATURADOS
| Estructura | Nombre común | Se encuentra en |
| C 18:2 n-6 | linoleico | aceites vegetales (girasol, maíz, soja, algodón, cacahuete..) |
| C 18: 3 n-3 | linolénico | soja, otros aceites vegetales |
| C 18:3 n-6 | gamma linolénico | aceite de onagra, borraja |
| C 18:4 n-3 | estearidónico | , aceites de pescado, semillas de borraja, onagra |
| C 20:4 n-6 | araquidónico | aceites de pescado |
| C 22:5 n-3 | clupanodónico | aceites de pescado |
| C 22:6 n-3 | docosahexaenoico | aceites de pescado |
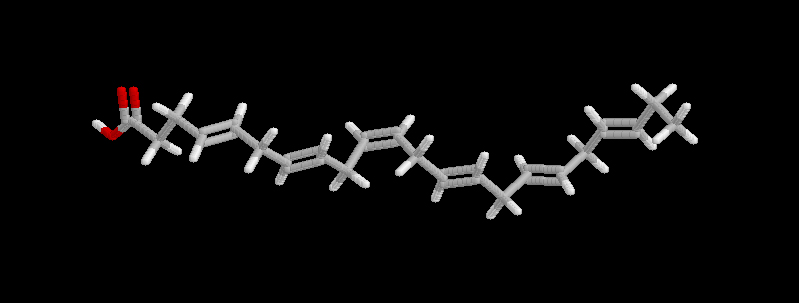
Ácido docosahexenoico (22:6 n-3)Los ácidos grasos poliinsaturados son fácilmente oxidables, tanto más cuanto mayor sea el número de dobles enlaces. A partir de tres insaturaciones, son francamente inestables, y las grasas en las que abundan solamente pueden utilizarse en buenas condiciones en la industria alimentaria tras su hidrogenación.
ácidos grasos menos frecuentes
En la mayoría de las grasas comunes, la longitud de la cadena de los ácidos grasos saturados y monoinsaturados es de 18 átomos de carbono como máximo, y de 24 carbonos para los poliinsaturados. Se exceptúan las ceras, en las que pueden encontrarse toda una serie de ácidos grasos saturados de hasta 35 carbonos de longitud. También en los aceites de pescado, procedentes del metabolismo de las ceras que acumula el zooplacton, se encuentran diversos ácidos grasos monoinsaturados largos.
ACIDOS GRASOS SATURADOS RAROS
| Estructura | Nombre común | Se encuentra en |
| C 20:0 | araquídico | aceite de cacahuete |
| C 22:0 | behénico | ceras |
| C 24:0 | lignocérico | aceite de cacahuete |
| C 26:0 | cerótico | cera de abejas |
ácidos grasos con estructuras peculiares
Como ya se ha indicado, los ácidos grasos comunes tienen la cadena con un número par de átomos de carbono. Sin embargo, las bacterias sintetizan frecuentemente ácido grasos con un número impar de átomos de carbono, que pasan a las grasas animales. En el caso de los rumiantes, la peculiaridad de su alimentación, muy dependiente de la fermentación bacteriana del rumen, hace que estos ácidos grasos se encuentren en su grasa y especialmente en la leche en un porcentaje pequeño, pero significativo. Los más abundantes son el 15:0 y el 17:0 También en algunos vegetales aparecen ácidos grasos de número impar de átomos de carbono, como el ácido pelargónico, de nueve átomos de carbono, producido por la ruptura oxidativa del ácido oleico. Por la misma razón, aparecen en la leche y grasa de los rumiantes indicios de ácidos grasos de cadena ramificada y ácidos grasos con dobles enlaces en configuración trans.
Los ácidos grasos trans se encuentran también en pequeñas cantidades en algunos aceites de semillas poco frecuentes, pero son muy abundantes en las grasas procesadas por hidrogenación. En la figura pueden verse las diferencias en la configuración entre los dos isómeros, cis y trans, del 18:1 n-9.
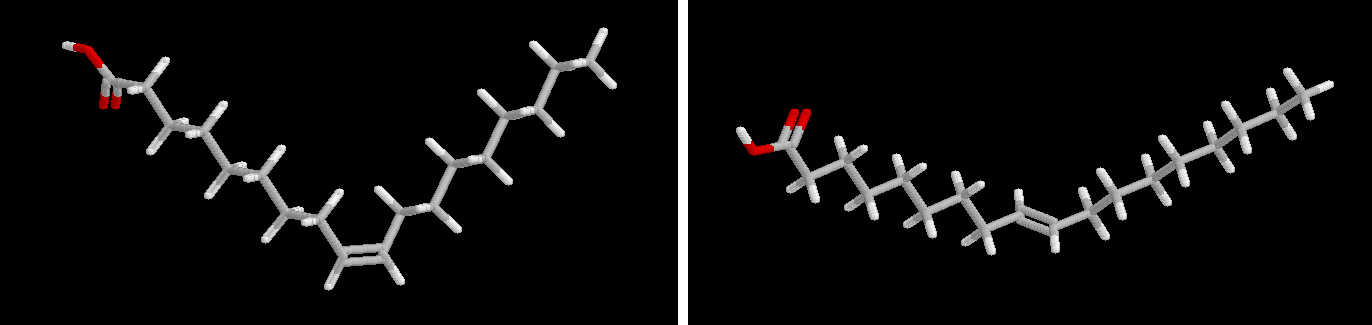
Ácido oleico Ácido elaidico OTROS ACIDOS GRASOS PECULIARES
| Estructura | Nombre común | Se encuentra en |
| C 17:0 | margárico | grasas de rumiantes |
| C 18:1 n-9 trans | elaídico | grasas hidrogenadas |
Existen también, en diversos vegetales, ácidos grasos con estructuras peculiares, que precisamente con su presencia hacen que el aceite que puede obtenerse de ellos no sea comestible, aunque puede ser muy útil en algunas industrias. El ácido crepenínico, presente en algunas semillas, tiene 18 carbonos, con un enlace triple y uno doble. El ácido ricinoleico es un derivado del ácido oleico que tiene un grupo hidroxilo en el carbono 7 (contando desde el metilo), y como su nombre indica, es abundante en el aceite de ricino, del que representa el 90% del total de ácidos grasos.
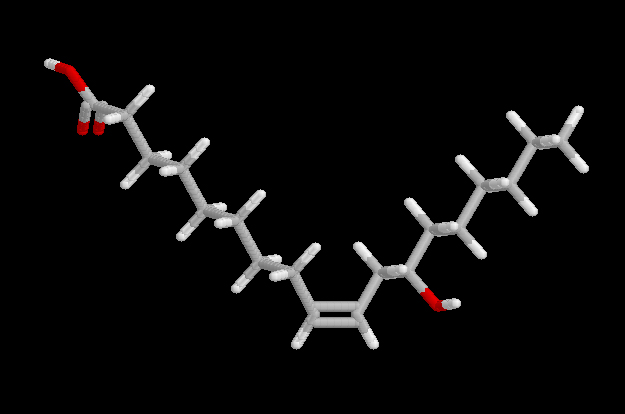
Ácido ricinoleicoEl ácido coriólico, presente en algunas semillas, también tiene un grupo OH. El floionólico, presente en el corcho, tienen tres grupos hidroxilo. Los ácidos vernólico y coronárico tienen anillos de epóxido (tres eslabones, uno de ellos un oxígeno).
Otras estructuras aún más peculiares son, por ejemplo, la del ácido colnelhénico, con un grupo éter en su cadena, que se forma en las patatas por oxidación enzimática del ácido linolénico. El ácido hidnocárpico y otros ácidos grasos de
Hydnocarpus tienen formando parte de la cadena un anillo insaturado de cinco eslabones. Se han utilizado en medicina.
TAREA
REALICE UN MAPA CONCEPTUAL