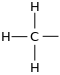
El grupo metilo forma parte de una "familia" de sustituyentes orgánicos llamados grupos alquilo alquímicos, ya que siguen un mismo patrón: sólo contienen átomos de carbono e hidrógeno, unidos por enlace covalente sencillo en la serie homóloga -(CH2)n-H con fórmula molecular CnH2n+1 y al ser un grupo funcional forman parte de una molécula mayor. Cuando un grupo metilo se separa de una molécula, se convierte en un radical metilo.
Si los ordenamos de menor a mayor número de átomos de C, los cuatro primeros tienen nombres específicos (metilo, etilo, propilo y butilo) mientras que los que siguen sólo se denominan con la raíz latina según el número de carbonos (pent-, hex-, etc.) y la terminación -il(o).
| Radical | Fórmula simplificada |
Fórmula semi-desarrollada |
|---|---|---|
| Metilo | -CH3 | -CH3 |
| Etilo | -C2H5 | -CH2-CH3 |
| Propilo | -C3H7 | -CH2-CH2-CH3 |
| Butilo | -C4H9 | -CH2-CH2-CH2-CH3 |
| Pentilo | -C5H11 | -CH2-CH2-CH2-CH2-CH3 |
| Hexilo | -C6H13 | -CH2-CH2-CH2-CH2-CH2-CH3 |
| Heptilo | -C7H15 | -CH2-CH2-CH2-CH2-CH2-CH2-CH3 |
| Octilo | -C8H17 | -CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 |
| Nonilo | -C9H19 | -CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 |
| Decilo | -C10H21 | -CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 |
Estructura
Hay que distinguir entre grupos alquilo de cadena recta y de cadena ramificada según la geometría de la cadena alquílica, es decir, la ausencia de ramificaciones (como en el grupo propil), o la presencia de las mismas (en el grupo isopropil).Según que el átomo de hidrógeno supuestamente eliminado pertenezca a un carbono terminal (carbono primario) o intermedio (carbono secundario, etc..) podemos distinguir entre grupos alquino primarios, secundarios y terciarios, ya que dicho átomo de H que falta definirá el carbono de unión entre el grupo alquilo y el resto de la molécula.
En la tabla inferior se observan dos grupos derivados del butano, eliminando el H en un carbono primario (n-butil) o secundario (sec-butil); y dos derivados del metilpropano, eliminando el H en un C primario (isopropil) o terciario (ter-butil).
| Grupo funcional | Símbolo | Fórmula | Estructura | Prefijo | Sufijo | Ejemplo |
|---|---|---|---|---|---|---|
| Grupo metilo | Me | -CH3 | 
|
metil- | -metano | 
|
| Grupo etilo | Et | -CH2CH3 | 
|
etil- | -etano | |
| Grupo propilo | n-Pr | -CH2CH2CH3 | 
|
propil- | N-propano | |
| i-Pr | -CH(CH3)2 | 
|
isopropil- | isopropano | 
| |
| Grupo butilo | _ | -CH2CH2CH2CH3 | butil- | -butano | ||
| _ | -CH2CH(CH3)2 | 
|
isobutil- | -isobutano | 
| |
| _ | -CH(CH3)CH2CH3 | 
|
sec-butil- | _ | ||
| _ | -C(CH3)3 | 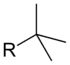
|
tert-butil- | _ | ||
| Grupo pentilo | _ | -CH2CH2CH2CH2CH3 | 
|
pentil- | -pentano |
Etilo
Estructura de un grupo típico "etilo".
La etilación es la introducción en un compuesto de un grupo funcional etilo, lo que origina un nuevo compuesto. Dependiente de los estados de oxidación de los compuestos involucrados, la etilación puede conllevar un aumento sensible y contundente en la estabilidad molecular de los compuestos resultantes.
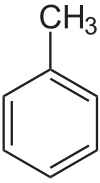
Metilo
Grupo metilo (en rosa) unido a una cadena de cinco átomos de carbono (en azul), en el 3-metilpentano.
No confundir con el radical metilo, (CH3), el cual deriva del metano (CH4) por eliminación de un átomo de hidrógeno,5 posee un electrón desapareado6 y existe como unidad molecular independiente aunque su vida media sea muy corta.
Nomenclatura
El grupo metilo es una ramificación o resto alquilo de un solo átomo de carbono en una cadena carbonada mayor o a un grupo funcional dentro de un compuesto orgánico. Es muy frecuente y se representa por CH3- (a veces, se abrevia como Me-) pero siempre forma parte de una molécula.Cuando se nombra un grupo metilo dentro del nombre de un compuesto, se omite la "o" final; por ejemplo, 2-metilpropano.
Por otro lado, si hay más de un grupo metilo en un compuesto se nombra la cadena principal según el número de carbono que contenga, y los radicales o sustituyentes se nombran delante, con el prefijo "di-" si aparecen dos grupos metilo, como en 1,3-dimetilbutano; "tri-" si aparecen tres grupos metilo, como en 2,2,3-trimetilbutano; "tetra-" si aparecen cuatro grupos metilo como en 2,2,3,3-tetrametilbutano,...y así sucesivamente, como en los siguientes ejemplos.
| Fórmula estructural | Fórmula semidesarrollada |
Fórmula abreviada (poco usada) |
Nombre |
|---|---|---|---|
| CH3- | Me- | Grupo metilo (nunca existe aislado) | |
| CH3-Cl | MeCl | Cloruro de metilo o clorometano | |
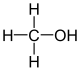
|
CH3-OH | MeOH | Alcohol metílico o metanol |
| CH3-CH(CH3)-CH3 | 2-metilpropano o metilpropano | ||
| CH3-CH(CH3)2-CH2-CH3 | 2,2-dimetilbutano |
Propiedades
- Es un grupo muy estable que se mantiene intacto en muchas reacciones químicas.
- Los enlaces carbono-hidrógeno poseen gran energía de disociación, superior a 100 kcal/mol, por lo que estos hidrógenos no poseen carácter ácido, no se separan del carbono. Esto contribuye a la escasa reactividad de los alcanos y de los grupos alquilo, como el metilo, dentro de una molécula frente a otros grupos funcionales más activos.
- Los enlaces carbono-hidrógeno no presentan polaridad debido a que el carbono y el hidrógeno poseen una electronegatividad parecida. Esto favorece la solubilidad de las sustancias con grupos alquilo en alcohol, acetona, éter y otros disolventes orgánicos pero no en agua.
- El átomo de C posee una hibridación sp3 (simetría tetraédrica) en el grupo metilo,7 a diferencia del radical metilo, en el que tiene hibridación sp2 (simetría triangular plana).
Geometría
En tres dimensiones, los enlaces que vienen del átomo de carbono en el grupo metilo (CH3, o H3C) están simétricamente situados apuntando a los vértices de un tetrahedro imaginario el átomo de carbono está en el medio. El grupo metilo está libre para rotar alrededor del enlace carbono-nitrógeno. Tanto CH3 como H3C son sólo representaciones bidimensionales como taquigráficas; el último es únicamente usado como una opción estética que el que la representa puede usar si piensa que el hidrógeno parecerá demasiado plegado contra el resto de la molécula.89Propilo
De izquierda a derecha: los dos grupos isómeros propil e isopropil (o 1-metiletil), y el grupo no isomérico ciclopropilo.
Hay dos formas isoméricas de propilo:
- con el sustituyente unido a uno de los carbonos extremos (llamada prop-1-il en la nomenclatura IUPAC, o n-propilo (Pr-n) en el viejo sistema de nomenclatura); y
- con el sustituyente unido al carbono de al medio (llamada prop-2-il en el sistema IUPAC, o isopropilo en el sistema viejo).
- Ejemplos
Etanoato de propilo, también llamado acetato de propilo.
- Esto es etanoato de propilo, un éster. El grupo propilo se añade a la molécula después del oxígeno de al medio.