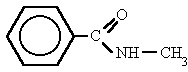
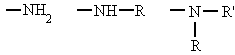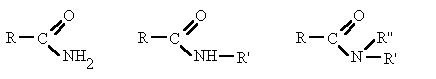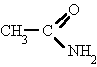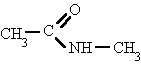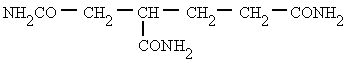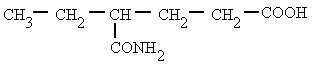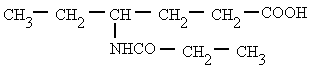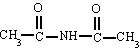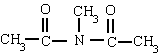Derivan de los ácidos carboxílicos
por substitución del grupo -OH por un grupo
dando
lugar a amidas sencillas, amidas N-sustituidas o N, N-disustituidas.
|
||||||||||||
|
||||||||||||
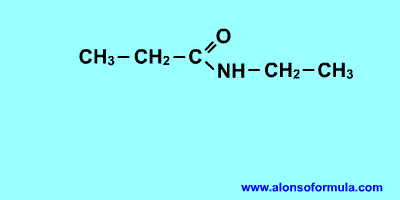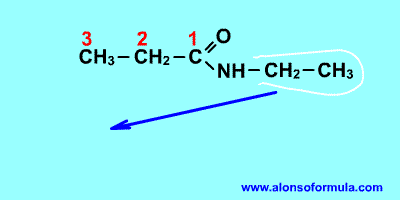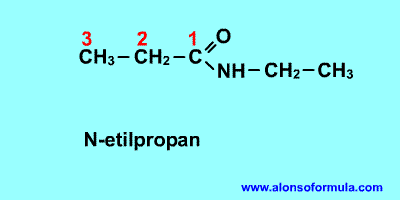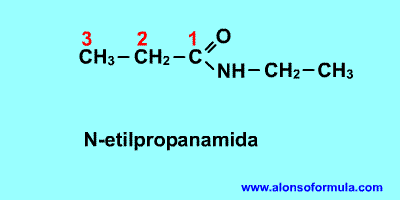
Nombra los radicales unidos al nitrógeno
precedidos de la N. Luego nombra la cadena que contiene el carbonilo terminada en -amida.
|
||||||||||||
La raíz anterior al sufijo -amida es la
cadena principal. Después del nitrógeno sitúa los radicales precedidos de la N.
Completa luego los hidrógenos.
|
||||||||||||
|
Lamarckismo
El lamarkismo
El lamarkismo es una corriente de pensamiento evolucionista que si bien en la actualidad se considera mayoritariamente no acertada ayudó en gran medida a que la evolución calara en las mentes de la sociedad. Actualmente se revisan ciertas formas de lamarckismo derivadas de la epigenética, en la que el ambiente modula los genes.
 El naturalista de Francia Jean-Baptiste de Lamarck propuso la primera teoría evolutiva de la historia moderna, el lamarckismo. Además de ser el que dio nombre a la ciencia que estudia los seres vivos, la biología.
El naturalista de Francia Jean-Baptiste de Lamarck propuso la primera teoría evolutiva de la historia moderna, el lamarckismo. Además de ser el que dio nombre a la ciencia que estudia los seres vivos, la biología.
En 1809 con la publicación de su libro Filosofía zoológica sugirió que los seres vivos no habían sido creadas tal y como las conocíamos en la actualidad (tanto el lamarckismo y el darwinismo intentaron siempre congraciar la evolución con la existencia de Dios). Lamarck, gran paleontólogo, sugería que los seres vivos habían evolucionado, más de 50 años antes de que Darwin publicase su “El origen de las especies”. Si bien cuando se escribió Filosofía zoológica no se tuvo muy en cuenta, Darwin se apoyó en los estudios de Lamarck para rellenar los huecos de su, por aquel entonces, endeble teoría evolutiva.
Según Lamarck, los seres vivos cambian para adaptarse a su entorno (completamente cierto y por aquella época innovador y enfrentado al dogma del fijismo de la creación). Los seres vivos tienden a aumentar su complejidad, lo que establecía una cronología taxonómica entre las diferentes especies, también acertado. Lamarck solo se equivocó, por la falta de conocimientos de genética de la época, en la forma en la que las características cambian para adaptarse al medio ambiente.
Según Lamarck el uso de un órgano lo refuerza y hace que se perfeccione, evolucione y pase estas habilidades adquiridas a la descendencia. Sin embargo ahora sabemos, con el neodarwinismo, que en una población se encuentran múltiples variaciones de una característica, gente con diferente fuerza en los brazos. Aquellos individuos con las variaciones que den mayor ventaja para sobrevivir dejarán más descendientes.
Por ejemplo, las jirafas no tienen el cuello largo debido a que cada generación lo ha ido estirando un poco de tal manera que el cuello ha ido creciendo con las generaciones. Tienen el cuello largo porque con el tiempo aquellos individuos con el cuello largo han dejado más hijos y los de cuello corto han dejado menos hijos, por lo que las variaciones genéticas de “cuellos cortos” no han pasado a la generación siguiente.dando an ido cruzando individuos de cuellos cada vez más largos.
El lamarkismo es una corriente de pensamiento evolucionista que si bien en la actualidad se considera mayoritariamente no acertada ayudó en gran medida a que la evolución calara en las mentes de la sociedad. Actualmente se revisan ciertas formas de lamarckismo derivadas de la epigenética, en la que el ambiente modula los genes.

Según el lamarckismo las jirafas adquirieron un cuello largo debido a tanto estirarlo para alimentarse.
En 1809 con la publicación de su libro Filosofía zoológica sugirió que los seres vivos no habían sido creadas tal y como las conocíamos en la actualidad (tanto el lamarckismo y el darwinismo intentaron siempre congraciar la evolución con la existencia de Dios). Lamarck, gran paleontólogo, sugería que los seres vivos habían evolucionado, más de 50 años antes de que Darwin publicase su “El origen de las especies”. Si bien cuando se escribió Filosofía zoológica no se tuvo muy en cuenta, Darwin se apoyó en los estudios de Lamarck para rellenar los huecos de su, por aquel entonces, endeble teoría evolutiva.
Lamarck se cuestionaba porqué los seres vivos eran diferentes de los fósiles. Por lo que se preguntó ¿cuál es el motor de este cambio?
La función crea el órgano. Este es el dogma del lamarckismo. El uso de un órgano
lo refuerza y perfecciona, evoluciona. Esto es verdad para las
habilidades, como el cálculo mental o la fuerza del brazo de un herrero.
La controversia estriba en que estas habilidades adquiridas pasen a la descendencia, porque si no pasan no es evolución. A principios del siglo XX Weisnann estableció la barrera de Weismann, demostrando que solo las células germinales pasan a la descendencia y por lo tanto las células somáticas, como las del cerebro del matemático o el brazo del herrero por mucho que se ejerciten no pasan su información o mejora a la siguiente generación, por lo que los hijos de un herrero tendrán brazos musculosos.Según Lamarck, los seres vivos cambian para adaptarse a su entorno (completamente cierto y por aquella época innovador y enfrentado al dogma del fijismo de la creación). Los seres vivos tienden a aumentar su complejidad, lo que establecía una cronología taxonómica entre las diferentes especies, también acertado. Lamarck solo se equivocó, por la falta de conocimientos de genética de la época, en la forma en la que las características cambian para adaptarse al medio ambiente.
Según Lamarck el uso de un órgano lo refuerza y hace que se perfeccione, evolucione y pase estas habilidades adquiridas a la descendencia. Sin embargo ahora sabemos, con el neodarwinismo, que en una población se encuentran múltiples variaciones de una característica, gente con diferente fuerza en los brazos. Aquellos individuos con las variaciones que den mayor ventaja para sobrevivir dejarán más descendientes.
Por ejemplo, las jirafas no tienen el cuello largo debido a que cada generación lo ha ido estirando un poco de tal manera que el cuello ha ido creciendo con las generaciones. Tienen el cuello largo porque con el tiempo aquellos individuos con el cuello largo han dejado más hijos y los de cuello corto han dejado menos hijos, por lo que las variaciones genéticas de “cuellos cortos” no han pasado a la generación siguiente.dando an ido cruzando individuos de cuellos cada vez más largos.