Evolución
Darwin
propuso que las especies cambian con el tiempo, que las especies nuevas
provienen de especies preexistentes y que todas las especies comparten
un ancestro común. En este modelo, cada especie tiene su propio conjunto
de diferencias (genéticas) heredables en relación con su ancestro
común, las cuales se han acumulado gradualmente durante periodos de
tiempo muy largos. La repetición de los eventos de ramificación, en los
que las nuevas especies se desprenden de un ancestro común, produce un
"árbol" de muchos niveles que une a todos los seres vivos.
Darwin
se refirió a este proceso, en el que los grupos de organismos cambian
en sus características heredables a lo largo de generaciones, como
"descendencia con modificaciones". Hoy en día, lo llamamos evolución.
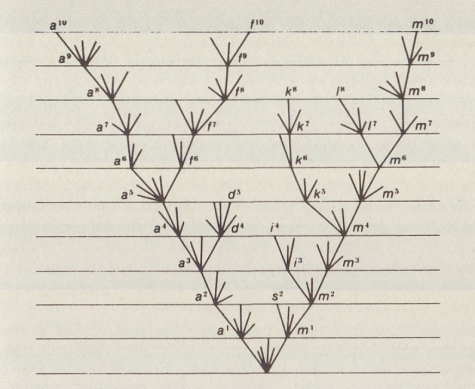
El boceto de Darwin que se ve arriba ilustra esta idea y muestra cómo
una especie puede ramificarse en dos a lo largo del tiempo, y cómo este
proceso puede repetirse muchas veces en el "árbol genealógico" de un
grupo de especies emparentadas.
Selección natural
Es
importante destacar que Darwin no solo propuso que los organismos
evolucionaban. Si ese hubiera sido el inicio y el fin de su teoría, ¡no
estaría en tantos libros de texto hoy en día! En cambio, Darwin también
propuso un mecanismo para la evolución: la selección natural.
Este mecanismo era elegante y lógico, y explicaba cómo podían
evolucionar las poblaciones (tener descendencia modificada) de tal
manera que se hacían más adecuadas para vivir en sus entornos con el
paso del tiempo.
El concepto de selección natural de Darwin está basado en varias observaciones fundamentales:
- Los rasgos a menudo son heredables. En los seres vivos, muchas características son hereditarias o pasan de padres a hijos. (Darwin sabía que esto sucedía, si bien no sabía que los rasgos se heredaban mediante genes).
- Se produce más descendencia de la que puede sobrevivir. Los organismos son capaces de generar más descendientes de los que su medio ambiente puede soportar, por lo que existe una competencia por los recursos limitados en cada generación.
- La descendencia varía en sus rasgos heredables. La descendencia en cualquier generación tendrá rasgos ligeramente distintos entre sí (color, tamaño, forma, etcétera), y muchas de estas características serán heredables.
Basado en estas sencillas observaciones, Darwin concluyó lo siguiente:
- En una población, algunos individuos tendrán rasgos heredables que les ayudarán a sobrevivir y reproducirse (dadas las condiciones del entorno, como los depredadores y las fuentes de alimentos existentes). Los individuos con los rasgos ventajosos dejarán más descendencia en la siguiente generación que sus pares, dado que sus rasgos los hacen más efectivos para la supervivencia y la reproducción.
- Debido a que los rasgos ventajosos son heredables y a que los organismos que los portan dejan más descendientes, los rasgos tenderán a volverse más comunes (presentarse en una mayor parte de la población) en la siguiente generación.
- En el transcurso de varias generaciones, la población se adaptará a su entorno (ya que los individuos con rasgos ventajosos en ese ambiente tendrán consistentemente un mayor éxito reproductivo que sus pares).
El
modelo de Darwin de evolución mediante selección natural le permitió
explicar los patrones que vio durante sus viajes. Por ejemplo, si las
especies de pinzones de las Galápagos compartían un ancestro común,
tenía lógica que tuvieran mucho parecido entre ellas (y con los pinzones
continentales, con quienes probablemente compartían un ancestro común).
Si los grupos de pinzones habían estado aislados en islas separadas
durante muchas generaciones, cada grupo se habría visto expuesto a un
ambiente diferente en que el que se habrían favorecido distintos rasgos
heredables, como los diferentes tamaños y formas de los picos para
aprovechar distintas fuentes de alimento. Estos factores pudieron
conducir a la formación de especies distintivas de cada isla.
Ejemplo: cómo puede actuar la selección natural
Para
hacer más concreta la idea de la selección natural, veamos un ejemplo
hipotético simplificado.
En este ejemplo, un grupo de ratones con una variación heredable en el
color del pelo (negro contra café claro) se acaba de mudar a un área
nueva donde las rocas son negras. En este ambiente hay halcones a los
que les gusta comer ratones y, contra el fondo de rocas negras, verán
con más facilidad a los cafés claro que a los negros.
Debido
a que los halcones verán y atraparán a los ratones cafés claro con más
facilidad, una parte relativamente grande de estos será devorada, en
comparación con una fracción mucho más pequeña de ratones negros. Si nos
fijamos en la proporción de ratones negros contra cafés claro en el
grupo sobreviviente (que no fue devorado), será mayor que en la
población inicial.
El
color del pelo es un carácter heredable (que puede pasar de padres a
hijos), por lo que una mayor proporción de ratones negros en el grupo
sobreviviente significa que habrá más ratones negros en la siguiente
generación. Después de varias generaciones de selección, la población
estará compuesta casi en su totalidad por ratones negros. Este cambio en
las características heredables de una población es un ejemplo de
evolución.