Distribución electrónica
Como resultado de los grandes esfuerzos realizados por muchos científicos, en la actualidad, la ciencia dispone de múltiples informaciones, comprobadas en la práctica, acerca de las leyes de distribución de los electrones en los átomos, partiendo del modelo de Bohr en la que señalaba la existencia de un núcleo formado por protones y neutrones, donde está concentrada la masa y la carga positiva del átomo. El electrón gira en órbitas circulares alrededor del núcleo, pero con algunas restricciones, como que solamente lo podía hacer en ciertas órbitas, cuya energía se encuentra cuantizada.
Por niveles electrónicos
Asumiendo el modelo de Bohr, los electrones se distribuyen en los átomos formando capas alrededor del núcleo que reciben el nombre de capas electrónicas o también niveles energéticos. Todos ellos forman la envoltura electrónica que rodea al núcleo. Mientras mayor número de capas electrónicas posea un átomo, mayor será la distancia que separa al núcleo de los electrones más externo.
Cada una de las capas electrónicas posee distinto contenido o nivel de energía y se encuentran a diferentes distancias del núcleo, de forma tal que la capa electrónica de menor nivel de energía será la más próxima al núcleo y las de mayores niveles energéticos se encontrarán más alejadas de éste. A medida que los electrones se encuentren en una capa electrónica alejada del núcleo con gran contenido energético estarán más débilmente unidos a éste. .
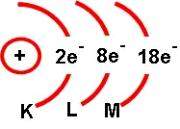
Los diferentes niveles energéticos toman valores enteros a partir de 1; por lo que el valor del primero, o sea, para el que corresponde a la capa más próxima al núcleo es 1, el que corresponde a la segunda capa es 2, etcétera. Estos niveles se representan también, a veces, por las letras K,L,M,N,O,P y Q.
Aunque de acuerdo con la concepción actual del átomo no es posible representarlo gráficamente, desde un punto de vista pedagógico es conveniente tener una representación visual, que, aunque no corresponda exactamente a la realidad, tampoco la contradiga, en la que se utilizan esquemas como el mostrado a continuación:
El núcleo se puede representar con un pequeño círculo donde se señalan tanto protones como indica su número atómico, y tantos neutrones como indica la diferencia entre el índice de masa y el número atómico. La envoltura se puede representar por arcos de circunferencia con centro en el núcleo. Cada arco corresponde a un nivel de energía y en el se coloca un número que indica los electrones que existen en ese nivel.
Se ha podido determinar el número máximo de electrones que pueden agruparse en los distintos niveles de energía y tenemos:
Al analizar bien lo anterior, se observa que cada nivel puede contener un número máximo de electrones igual a 2n2, donde n puede ser 1,2,3, etc., según el nivel energético. Aunque esto no quiere decir que siempre tendrán ese número máximo de electrones. Así, se tendrá que: .
El máximo número de electrones en la penúltima capa es 18 Si la penúltima capa no está completa, el máximo número de electrones en la capa más externa es 2
Particularidades de los electrones de los últimos niveles y la tabla periódica
Puesto que la capa K solo puede alojar dos electrones quedará completa en el gas inerte Helio. Después de este, se va llenando la capa L, con un electrón en el Litio hasta ocho en el Neón, cuya situación es análoga a la del Helio. Con dos en la capa K y ocho en la L quedan ambas capas totalmente ocupadas, mientras que las exteriores a ellas continúan vacías por completo.
El Neón es también un gas inerte, lo que significa que tras un período o ciclo de ocho átomos reaparece la propiedad de la inercia química. En los ocho átomos siguientes, los electrones se adicionan a la tercera capa, M, aumentando gradualmente su número desde el Sodio hasta ocho en el Argón. Cabria suponer que este elemento, número 18 no debería ser un gas inerte, ya que de acuerdo al diagrama de los niveles energéticos la capa M puede admitir hasta diez electrones más, esto es, 18; pero la observación nos dice que el Argón es un gas inerte, y que por tanto, la tercera capa debe considerarse completa cuando contenga ocho electrones.
Desde el punto de vista químico los niveles más externos, y fundamentalmente el último, son los más importantes; pues ellos:
- Permite explicar la recurrencia periódica de los elementos, sus propiedades dependen esencialmente del número de electrones que contiene el nivel energético más externo.
Por ejemplo, en el caso del Litio este posee un electrón en la capa mas externa (nivel L), y lo mismo sucede con el Sodio, aunque se encuentra el electrón en el nivel M. En la tabla periódica los elementos químicos con propiedades semejantes se sitúan uno debajo de otros, lo que equivale a reunir en un grupo aquellos átomos que contienen igual número de electrones en su nivel energético más externo
- Son los electrones que actúan cuando se produce una reacción química.
Por ello con frecuencia los átomos también pueden representar electrónicamente, de un modo simplificado, indicando sólo los electrones del nivel más externo por medio de puntos junto a su símbolo, a esta representación se le llama representación electrónica simplificada o estructura electrónica simplificada. Estas representaciones son llamadas estructuras de Lewis.
Por ejemplo:
El modelo de Bohr no puede ser aplicado a átomos más complejos o a moléculas, manifestado en la distribución electrónica por niveles de energía. Es un modelo semiclásico, porque supone la cuantización de la energía del átomo, pero describe el movimiento del electrón en forma de una trayectoria circular alrededor del núcleo, tal como la física clásica de Newton describe el movimiento de los planetas alrededor del sol y permite calcular la posición de estos en cualquier instante de tiempo.
De la evidencia acumulada del estudio de diversos fenómenos a la escala atómica surgió el convencimiento de que la física de Newton no era aplicable a los electrones y a las demás partículas pequeñas. A partir de ello se plasmó una nueva visión del mundo físico: la mecánica cuántica.
No hay comentarios:
Publicar un comentario