Configuración Electrónica de los Elementos
Vamos a estudiar la configuración electrónica o también llamada distribución electrónica.
Más adelante te enseñaremos una regla (regla de la diagonal) muy sencilla para obtener la configuración electrónica de cualquier elemento.
Además, abajo del todo de la página te dejamos una tabla con la configuración electrónica de todos los elementos, donde podrás comprobar si la tuya es correcta o no.
Aquí te vamos a explicar el cómo se hace y el por qué, cómo siempre de forma clara y sencilla.
Vamos a estudiar la configuración electrónica o también llamada distribución electrónica.
Más adelante te enseñaremos una regla (regla de la diagonal) muy sencilla para obtener la configuración electrónica de cualquier elemento.
Además, abajo del todo de la página te dejamos una tabla con la configuración electrónica de todos los elementos, donde podrás comprobar si la tuya es correcta o no.
Aquí te vamos a explicar el cómo se hace y el por qué, cómo siempre de forma clara y sencilla.
Átomo: Componentes y Órbitas
Recuerda que lo átomos tienen un núcleo donde se encuentran los protones y los neutrones, pero alrededor del núcleo están los electrones girando en las llamadas órbitas.
Un átomo puede tener varias órbitas alrededor de su núcleo y sobre las cuales están girando sus electrones.
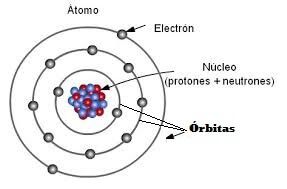
Recuerda que lo átomos tienen un núcleo donde se encuentran los protones y los neutrones, pero alrededor del núcleo están los electrones girando en las llamadas órbitas.
Un átomo puede tener varias órbitas alrededor de su núcleo y sobre las cuales están girando sus electrones.

¿Qué es la Configuración Electrónica?
La Configuración o Distribución electrónica nos dice como están ordenados los electrones en los distintos niveles de energía (órbitas), o lo que es lo mismo como están distribuidos los electrones alrededor del núcleo de su átomo.
¿Cómo saber los electrones que tienen los átomos en cada una de sus órbita?
Pues bien, eso es lo que se llama la configuración electrónica de un elemento de la tabla periódica.
Poco a poco lo iremos aprendiendo.
¿Para que queremos saber esto?.
Por ejemplo, es muy útil o mejor dicho imprescindible para hacer el enlace covalente y los enlaces iónicos y conocer los llamados electrones de valencia, que son el número de electrones que tiene el átomo de un elemento en su última capa u órbita (subnivel).
Lo primero, cuanto más alejado del núcleo esté girando el electrón mayor es su nivel de energía.
Los electrones, de un átomo, que tengan la misma energía se dice que están en el mismo nivel de energía.
Estos niveles de energía también se llaman orbitales de energía.
La Configuración o Distribución electrónica nos dice como están ordenados los electrones en los distintos niveles de energía (órbitas), o lo que es lo mismo como están distribuidos los electrones alrededor del núcleo de su átomo.
¿Cómo saber los electrones que tienen los átomos en cada una de sus órbita?
Pues bien, eso es lo que se llama la configuración electrónica de un elemento de la tabla periódica.
Poco a poco lo iremos aprendiendo.
¿Para que queremos saber esto?.
Por ejemplo, es muy útil o mejor dicho imprescindible para hacer el enlace covalente y los enlaces iónicos y conocer los llamados electrones de valencia, que son el número de electrones que tiene el átomo de un elemento en su última capa u órbita (subnivel).
Lo primero, cuanto más alejado del núcleo esté girando el electrón mayor es su nivel de energía.
Los electrones, de un átomo, que tengan la misma energía se dice que están en el mismo nivel de energía.
Estos niveles de energía también se llaman orbitales de energía.
Orbitales de Energía
En la actualidad la periferia del núcleo (su alrededor) se divide en 7 niveles de energía diferentes, numerados del 1 al 7, y en los que están distribuidos los electrones, lógicamente en orden según su nivel de energía.
Los electrones con menos energía estarán girando en el nivel 1.
Pero además cada nivel se divide en subniveles.
Estos subniveles en los que se divide cada nivel pueden llegar a ser hasta 4. A estos 4 subniveles se les llama: s, p, d, f.
Resumen: niveles de energía hay del 1 al 7 y subniveles hay 4 el s, p, d y el f.
OJO hay átomos que no tienen los 4 subniveles, como veremos más adelante, y átomos que no tienen los 7 niveles de energía, pueden tener menos.
Esto es precisamente lo que queremos averiguar, cuantos niveles y subniveles de energía tiene un átomo concreto y cuantos electrones tiene en cada uno de estos subniveles y niveles, es decir su Configuración Electrónica.
Además, hay algo muy importante, en cada subnivel solo podemos tener un número máximo de electrones.
Esto hace que podamos saber el número de electrones fácilmente, o lo que es lo mismo la distribución electrónica.
En el subnivel s solo puede haber como máximo 2 electrones, en el p 6, en el d 10 y en el f 14. (en cada nivel hay 4 más que en el nivel anterior, es fácil de recordar).
Veámoslo con una imagen.
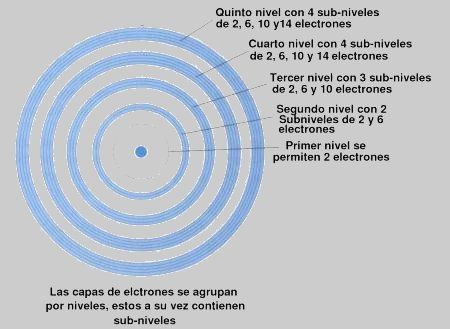
Fíjate en la imagen que en el nivel 1 (no se aprecia el círculo en la imagen pero está ahí) solo se permiten 2 electrones girando en ese nivel y además solo tiene un subnivel, el s. No hay ningún átomo que tenga más de 2 electrones girando en el primer nivel de energía (puede tener 1 o 2 átomos).
Si ahora pasamos al nivel 2, vemos que tiene 2 subniveles, lógicamente el s y el p.
Pero claro en el nivel s solo habrá como máximo 2 electrones y en el p como máximo 6.
Si seguimos viendo la imagen nos daremos cuenta de lo siguiente.
En la actualidad la periferia del núcleo (su alrededor) se divide en 7 niveles de energía diferentes, numerados del 1 al 7, y en los que están distribuidos los electrones, lógicamente en orden según su nivel de energía.
Los electrones con menos energía estarán girando en el nivel 1.
Pero además cada nivel se divide en subniveles.
Estos subniveles en los que se divide cada nivel pueden llegar a ser hasta 4. A estos 4 subniveles se les llama: s, p, d, f.
Resumen: niveles de energía hay del 1 al 7 y subniveles hay 4 el s, p, d y el f.
OJO hay átomos que no tienen los 4 subniveles, como veremos más adelante, y átomos que no tienen los 7 niveles de energía, pueden tener menos.
Esto es precisamente lo que queremos averiguar, cuantos niveles y subniveles de energía tiene un átomo concreto y cuantos electrones tiene en cada uno de estos subniveles y niveles, es decir su Configuración Electrónica.
Además, hay algo muy importante, en cada subnivel solo podemos tener un número máximo de electrones.
Esto hace que podamos saber el número de electrones fácilmente, o lo que es lo mismo la distribución electrónica.
En el subnivel s solo puede haber como máximo 2 electrones, en el p 6, en el d 10 y en el f 14. (en cada nivel hay 4 más que en el nivel anterior, es fácil de recordar).
Veámoslo con una imagen.

Fíjate en la imagen que en el nivel 1 (no se aprecia el círculo en la imagen pero está ahí) solo se permiten 2 electrones girando en ese nivel y además solo tiene un subnivel, el s. No hay ningún átomo que tenga más de 2 electrones girando en el primer nivel de energía (puede tener 1 o 2 átomos).
Si ahora pasamos al nivel 2, vemos que tiene 2 subniveles, lógicamente el s y el p.
Pero claro en el nivel s solo habrá como máximo 2 electrones y en el p como máximo 6.
Si seguimos viendo la imagen nos daremos cuenta de lo siguiente.
¡¡¡Importante Niveles y Subniveles!!!
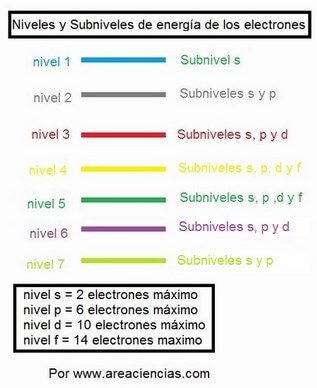
Fíjate que fácil: En el nivel 1 hay un subnivel, en el 2, 2 subniveles, en el 3, 3 subniveles y en el 4 hay 4 subniveles. ¿Fácil NO?.
Los últimos niveles un poco diferentes, por ejemplo en el 5, hay 4 subniveles, no puede tener más porque solo existen 4.
Y ahora vamos a contar al revés, en el nivel 6, 3 subniveles y en el último nivel, el 7 solo habrá…
¿Cuantos?
Pues si, habrá 2 subniveles.
Además, si hay un subnivel siempre será el s, si hay 2 serán el s y el p, si hay 3 serán el s, el p y el d, y si hay 4 subniveles serán el s, el p, el d y el f.
Concretemos más nivel a nivel:
– Primero de todo, recordar que en el subnivel s solo puede haber como máximo 2 electrones, en el p 6, en el d 10 y en el f 14.
En cada nivel tendremos:
– En el nivel 1 solo hay un subnivel, y lógicamente será el s.
– El nivel 2 hay 2 subniveles, el s y el p.
– En el nivel 3 hay 3 subniveles el s, el p y el d.
– En el nivel 4 hay 4 subniveles, el s, el p, el d y el f.
Pero OJO el nivel 5 tiene 4 subniveles también, pero en el nivel 6 solo tiene 3 (hasta el d) y en el 7 solo dos subniveles el s y el p.
Fíjate que fácil: En el nivel 1 hay un subnivel, en el 2, 2 subniveles, en el 3, 3 subniveles y en el 4 hay 4 subniveles. ¿Fácil NO?.
Los últimos niveles un poco diferentes, por ejemplo en el 5, hay 4 subniveles, no puede tener más porque solo existen 4.
Y ahora vamos a contar al revés, en el nivel 6, 3 subniveles y en el último nivel, el 7 solo habrá…
¿Cuantos?
Pues si, habrá 2 subniveles.
Además, si hay un subnivel siempre será el s, si hay 2 serán el s y el p, si hay 3 serán el s, el p y el d, y si hay 4 subniveles serán el s, el p, el d y el f.
Concretemos más nivel a nivel:
– Primero de todo, recordar que en el subnivel s solo puede haber como máximo 2 electrones, en el p 6, en el d 10 y en el f 14.
En cada nivel tendremos:
– En el nivel 1 solo hay un subnivel, y lógicamente será el s.
– El nivel 2 hay 2 subniveles, el s y el p.
– En el nivel 3 hay 3 subniveles el s, el p y el d.
– En el nivel 4 hay 4 subniveles, el s, el p, el d y el f.
Pero OJO el nivel 5 tiene 4 subniveles también, pero en el nivel 6 solo tiene 3 (hasta el d) y en el 7 solo dos subniveles el s y el p.

Vamos a estudiar la configuración electrónica o también llamada distribución electrónica.
Más adelante te enseñaremos una regla (regla de la diagonal) muy sencilla para obtener la configuración electrónica de cualquier elemento.
Además, abajo del todo de la página te dejamos una tabla con la configuración electrónica de todos los elementos, donde podrás comprobar si la tuya es correcta o no.
Aquí te vamos a explicar el cómo se hace y el por qué, cómo siempre de forma clara y sencilla
Átomo: Componentes y Órbitas
Recuerda que lo átomos tienen un núcleo donde se encuentran los protones y los neutrones, pero alrededor del núcleo están los electrones girando en las llamadas órbitas.
Un átomo puede tener varias órbitas alrededor de su núcleo y sobre las cuales están girando sus electrones.

¿Qué es la Configuración Electrónica?
La Configuración o Distribución electrónica nos dice como están ordenados los electrones en los distintos niveles de energía (órbitas), o lo que es lo mismo como están distribuidos los electrones alrededor del núcleo de su átomo.
¿Cómo saber los electrones que tienen los átomos en cada una de sus órbita?
Pues bien, eso es lo que se llama la configuración electrónica de un elemento de la tabla periódica.
Poco a poco lo iremos aprendiendo.
¿Para que queremos saber esto?.
Por ejemplo, es muy útil o mejor dicho imprescindible para hacer el enlace covalente y los enlaces iónicos y conocer los llamados electrones de valencia, que son el número de electrones que tiene el átomo de un elemento en su última capa u órbita (subnivel).
Lo primero, cuanto más alejado del núcleo esté girando el electrón mayor es su nivel de energía.
Los electrones, de un átomo, que tengan la misma energía se dice que están en el mismo nivel de energía.
Estos niveles de energía también se llaman orbitales de energía.
Orbitales de Energía
En la actualidad la periferia del núcleo (su alrededor) se divide en 7 niveles de energía diferentes, numerados del 1 al 7, y en los que están distribuidos los electrones, lógicamente en orden según su nivel de energía.
Los electrones con menos energía estarán girando en el nivel 1.
Pero además cada nivel se divide en subniveles.
Estos subniveles en los que se divide cada nivel pueden llegar a ser hasta 4. A estos 4 subniveles se les llama: s, p, d, f.
Resumen: niveles de energía hay del 1 al 7 y subniveles hay 4 el s, p, d y el f.
OJO hay átomos que no tienen los 4 subniveles, como veremos más adelante, y átomos que no tienen los 7 niveles de energía, pueden tener menos.
Esto es precisamente lo que queremos averiguar, cuantos niveles y subniveles de energía tiene un átomo concreto y cuantos electrones tiene en cada uno de estos subniveles y niveles, es decir su Configuración Electrónica.
Además, hay algo muy importante, en cada subnivel solo podemos tener un número máximo de electrones.
Esto hace que podamos saber el número de electrones fácilmente, o lo que es lo mismo la distribución electrónica.
En el subnivel s solo puede haber como máximo 2 electrones, en el p 6, en el d 10 y en el f 14. (en cada nivel hay 4 más que en el nivel anterior, es fácil de recordar).
Veámoslo con una imagen.

Fíjate en la imagen que en el nivel 1 (no se aprecia el círculo en la imagen pero está ahí) solo se permiten 2 electrones girando en ese nivel y además solo tiene un subnivel, el s. No hay ningún átomo que tenga más de 2 electrones girando en el primer nivel de energía (puede tener 1 o 2 átomos).
Si ahora pasamos al nivel 2, vemos que tiene 2 subniveles, lógicamente el s y el p.
Pero claro en el nivel s solo habrá como máximo 2 electrones y en el p como máximo 6.
Si seguimos viendo la imagen nos daremos cuenta de lo siguiente.
¡¡¡Importante Niveles y Subniveles!!!
Fíjate que fácil: En el nivel 1 hay un subnivel, en el 2, 2 subniveles, en el 3, 3 subniveles y en el 4 hay 4 subniveles. ¿Fácil NO?.
Los últimos niveles un poco diferentes, por ejemplo en el 5, hay 4 subniveles, no puede tener más porque solo existen 4.
Y ahora vamos a contar al revés, en el nivel 6, 3 subniveles y en el último nivel, el 7 solo habrá…
¿Cuantos?
Pues si, habrá 2 subniveles.
Además, si hay un subnivel siempre será el s, si hay 2 serán el s y el p, si hay 3 serán el s, el p y el d, y si hay 4 subniveles serán el s, el p, el d y el f.
Concretemos más nivel a nivel:
– Primero de todo, recordar que en el subnivel s solo puede haber como máximo 2 electrones, en el p 6, en el d 10 y en el f 14.
En cada nivel tendremos:
– En el nivel 1 solo hay un subnivel, y lógicamente será el s.
– El nivel 2 hay 2 subniveles, el s y el p.
– En el nivel 3 hay 3 subniveles el s, el p y el d.
– En el nivel 4 hay 4 subniveles, el s, el p, el d y el f.
Pero OJO el nivel 5 tiene 4 subniveles también, pero en el nivel 6 solo tiene 3 (hasta el d) y en el 7 solo dos subniveles el s y el p.

TAREA
REALICE TRES PREGUNTAS DE LAS PÁGINAS 40 Y 41 DE SU TEXTO DE LAS 21 PROPUESTAS
No hay comentarios:
Publicar un comentario