¿Qué son los gases ideales?
Se denomina gases ideales a un gas hipotético o teórico, es decir, imaginario, que estaría compuesto por partículas desplazándose aleatoriamente y sin interactuar entre sí.
Se trata de un concepto útil para la utilización de la mecánica estadística, a través de una ecuación de estado simplificada que se conoce como Ley de gases ideales.
Muchos de los gases reales conocidos en la química se comportan a temperatura y presión ambientales como un gas ideal, al menos desde una perspectiva cuantitativa. Esto permite que sean estudiados como gases ideales dentro de ciertos parámetros razonables.
Sin embargo, el modelo de los gases ideales tiende a fallar en cuanto varían las condiciones de temperatura y presión, pues en esas condiciones la interacción y el tamaño intermoleculares son importantes.
De todas formas, este modelo no es apropiado para gases pesados.
Ver además: Fluidos
Tipos de gases ideales
Existen tres tipos básicos de gases ideales, de acuerdo al tipo de enfoque físico elegido para su planteamiento:
- Gas ideal de Maxwell-Boltzmann. Se clasifica a su vez en gas ideal termodinámico clásico, y gas ideal cuántico, dependiendo del enfoque físico aplicado en su estudio.
- Gas ideal cuántico de Bose. Compuesto por bosones.
- Gas ideal cuántico de Fermi. Compuesto por fermiones.
¿Cómo se define un gas ideal?
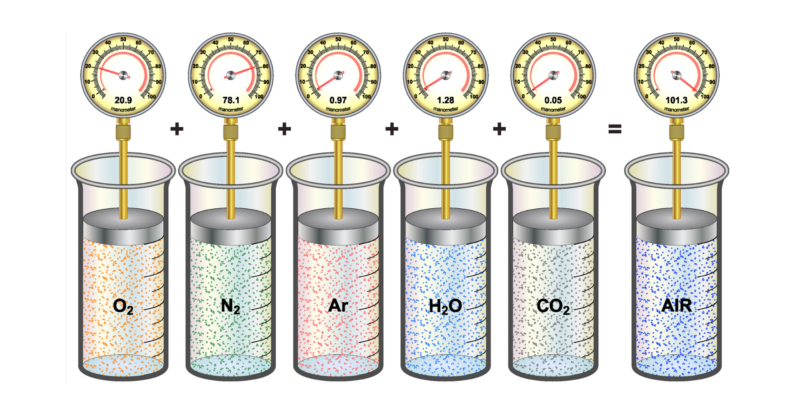
Un gas ideal, como hemos dicho, es una sustancia en estado gaseoso cuyas partículas se mantienen en un número estable, sin efectos electromagnéticos.
Su energía cinética es directamente proporcional a la temperatura. Las colisiones entre las moléculas que lo componen (entre sí y con el recipiente o contenedor) son de tipo elástico, conservando el momento y la energía cinética.
Los gases reales se aproximan a este comportamiento ideal sólo a temperatura y presión ambiente, cuando se trata de gases monoatómicos.
Propiedades de los gases ideales
Las principales propiedades de los gases ideales son cuatro:
- Poseen siempre un mismo número de moléculas
- No existen fuerzas de atracción o repulsión entre sus moléculas.
- No existe colapso entre las moléculas ni cambios en su naturaleza física (cambios de fase).
- Las moléculas del gas ideal ocupan siempre el mismo volumen a las mismas condiciones de presión y temperatura.
No hay comentarios:
Publicar un comentario