Rendimiento de las reacciones.
El rendimiento de una reacción es la cantidad de producto que se puede obtener al llevarse a cabo una reacción completamente. Existen tres tipos de rendimiento:
a) Rendimiento teórico. Es aquel que, por la estequiometría, tendríamos que obtener de acuerdo con la reacción balanceada. Se dice que este rendimiento es lo máximo que podemos obtener.
b) Rendimiento real. Como en muchas de las mediciones o predicción, no siempre sucede lo que “debería”. Este rendimiento es lo que verdaderamente obtenemos en la experimentación. Generalmente es menor al rendimiento teórico.
c) Rendimiento porcentual. Es el rendimiento real entre el rendimiento teórico multiplicado por 100.
EJEMPLO
1.- El titanio es un metal muy fuerte y resistente a la corrosión, usado en la construcción de naves espaciales, aviones y motores para éstos. Se prepara por reducción del cloruro de titanio (IV) con magnesio fundido de 950°C a 1150°C.
En determinada operación 3.55X104 kg de TiCl4 reaccionan con 1.12X104 kg de Mg.
a) Calcular el rendimiento teórico de Ti en kilogramos.
Lo primero que se puede observar es que la reacción no está balanceada, por lo que vamos a proceder a balancearla y posteriormente escribir las masas teóricas y prácticas:
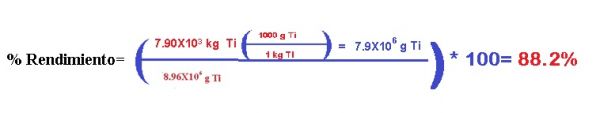
b) Calcular el rendimiento porcentual si en realidad se obtienen 7.90X103 kg de Ti.
Para el % de rendimiento solamente tenemos que sustituir los datos en la fórmula, únicamente agregando un factor de conversión de kilogramos a gramos para el rendimiento real:
TAREA. Resuelva el siguiente problema
a) El fluoruro de hidrógeno se usa en la manufactura de freones (que destruyen el ozono de la atmósfera) y en la producción de aluminio metálico. Se prepara por la reacción: |
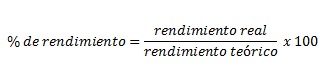



No hay comentarios:
Publicar un comentario