Teoría de las colisiones
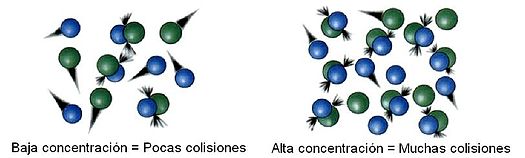
La teoría de las colisiones es una teoría propuesta por Max Trautz1 en 1916 y por William Lewis en 1918, que explica cómo ocurren las reacciones químicas y por qué las velocidades de reacción difieren para diversas reacciones.2 Para que una reacción ocurra las partículas reaccionantes deben colisionar. Solo una cierta fracción de las colisiones totales causan un cambio químico; estas son llamadas colisiones exitosas o completadas. Las colisiones exitosas tienen energía suficiente (energía de activación), al momento del impacto, para romper los enlaces existentes y formar nuevos enlaces, resultando en los productos de la reacción. El incrementar la concentración de los reactivos y aumentar la temperatura lleva a más colisiones y por tanto a más colisiones exitosas, incrementando la velocidad de la reacción.
Cuando un catalizador está involucrado en la colisión entre las moléculas reaccionantes, se requiere una menor energía para que tome lugar el cambio químico, y por lo tanto más colisiones tienen la energía suficiente para que ocurra la reacción. La velocidad de reacción por lo tanto también se incrementa.
La teoría de las colisiones está cercanamente relacionada con la cinética química.
Constante de velocidad
La constante de velocidad para una reacción bimolecular en fase gaseosa, como la predice la teoría de las colisiones es:
donde:
- es la frecuencia de colisión.3
- es el factor estérico.4
- es la energía de activación de la reacción.
- es la temperatura.
- es la constante universal de los gases ideales.
REALICE UN MAPA CONCEPTUAL






No hay comentarios:
Publicar un comentario