Molaridad.
Esta unidad de concentración se basa en el volumen de una solución y por ello es conveniente utilizarla en los procedimientos del laboratorio en donde la cantidad medida es el volumen de solución. La molaridad se define como el número de moles de soluto por litro de solución (también como el número de milimoles de soluto por mililitro de solución):
![]()
en donde M es la molaridad, n es el número de moles de soluto y V es el volumen de solución expresado en litros. Ya que:
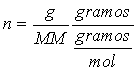
en donde g representa los gramos de soluto y MM la masa molecular del soluto, de aquí que:
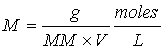
Cuando se da la información de la concentración de una especie química en moles por litro esto se indica poniendo la fórmula de la especie dada entre corchetes. Por ejemplo, [H+] = 0.1 nos indica que la concentración de H+ es de 0.1 moles/litro.
Tratándose del equilibrio químico, es necesario distinguir entre la concentración analítica que no es más que el número total de moles de un soluto en un litro de solución y la molaridad analítica de una especie en equilibrio. Por ejemplo, si añadimos 0.1 moles de ácido acético a un litro de agua, tendremos una concentración analítica de ácido acético 0.1 molar. Sin embargo en virtud del equilibrio:
![]()
una fracción de las moléculas de ácido acético estará ionizada por lo que la concentración real de la especie CH3COOH será menor que 0.1 molar.
Algunos reactivos de mucha aplicación en análisis químico son manufacturados en estado líquido como una disolución concentrada de la sustancia de interés. Entre estas sustancias tenemos la mayoría de los ácidos que con mayor frecuencia se utilizan en los laboratorios como son el ácido sulfúrico, clorhídrico, etc. En los frascos de estos ácidos concentrados nos indican los fabricantes su porcentaje (% masa/masa) y densidad de la solución del ácido. Con estos datos podemos calcular el volumen necesario del ácido concentrado para preparar un ácido más diluido. Para ello nos basamos en la masa de reactivo necesaria para preparar la solución es igual a la masa que encontramos de ese reactivo en una solución concentrada. Por ejemplo para una solución diluida cuya concentración se da en forma de molaridad:
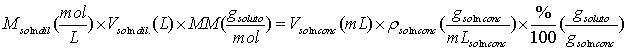
En general la ley de conservación de la masa, en este caso particular aplicada a las soluciones, nos exige que el número de moles al preparar una dilución de una solución se mantenga constante y esto se expresa por:
![]()
Ejemplos de cálculos relacionados con la molaridad.
Ejercicio 1. Calcule la molaridad de una solución que contiene 6.00 g de NaCl (MM 58.44) en 200 ml de solución.
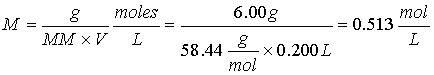
Ejercicio 2. Calcule el número de moles y el número de gramos de KMnO4 (MM 158.0) en 3.00 litros de una solución 0.250 M.
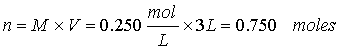
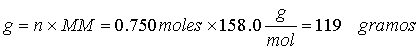
Ejercicio 3. Cuántos mililitros de H2SO4 concentrado al 95% (r = 1.84 g/mL) se necesitarán para preparar 2.5 l de solución 2 M de este ácido.
El número de gramos de H2SO4 necesarios será:
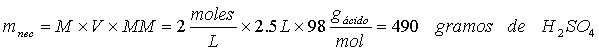
en cada mL de H2SO4 hay:
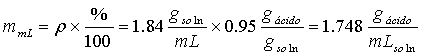
Y la cantidad de mL necesarios será:
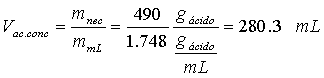
TAREA
1. EN SU CUADERNO DEFINA QUE ES MOLARIDAD Y SU REALACION MATEMATICA O FORMULA.
2. TERMINE EL EJERCICIO PROPUESTO EN CLASES
No hay comentarios:
Publicar un comentario