Mezclas
Al hablar de una mezcla diremos
que es la unión de dos o más sustancias o compuestos, en la que cada una
mantiene sus propiedades; y luego pueden separarse fácilmente por
acción mecánica, obteniéndose las sustancias primarias sin ninguna
alteración. Para ilustrar este concepto te invitamos a realizar el
siguiente experimento Materiales: Una hoja de papel Un imán Una
cucharada de tierra seca Un cuarto de cucharada de limallas de hierro.
Procedimiento: Coloca sobre la hoja de papel la tierra uniendo con las
limallas de hierro (esto es la mezcla), siendo la tierra y las limallas
las sustancias o componentes primarios; extiende la mezcla sobre la
mitad de la hoja, por debajo del papel pasa el imán hacia la mitad que
no contiene mezcla (el paso del imán es una acción mecánica) lo que
observarás es que las limallas son atraídas por el imán, separándose
éstas de la tierra, obteniendo nuevamente, sin alteración alguna, las
dos sustancias primarias.
Características de las mezclas
Para que se pueda llevar a cabo una mezcla es necesario que se cumplan ciertas características:
Que las sustancias que intervengan no pierdan sus propiedades.
Ejemplo: al mezclar, en un vaso con agua, una cucharada de sal,
el agua sigue siendo líquida y la sal no perdió su sabor salado.
La cantidad de sustancias que forman una mezcla puede ser variable.
Ejemplo: Si al vaso de agua se le agrega una o tres cucharadas de sal.
Cuando se unen las sustancias para formar la mezcla no hay desprendimiento ni absorción de energía eléctrica, calorífica o luminosa.
Ejemplo: al mezclar el agua con la sal no hay desprendimiento de electricidad, calor o luz.
Las sustancias que intervienen pueden separarse por acciones mecánicas o físicas.
Ejemplo: mediante la evaporación del agua por la acción del calor, podemos volver a obtener la sal.
tipos de mezclas
Las mezclas pueden ser homogéneas o heterogéneas
Mezclas homogéneas.- Son en las que las sustancias que intervienen no se pueden diferenciar a simple vista.
Ejemplo: la sangre, solo al verla no podemos diferenciar el plasma de los elementos figurados.
Otros ejemplos de mezcla homogéneas: la leche, el aire, el agua.
Mezclas heterogéneas.- Son las mezclas en las que las sustancias que intervienen se pueden diferenciar a simple vista.
Ejemplo: el agua con el aceite, es un ejemplo muy
claro de mezcla heterogénea. Como tú sabes el aceite es una sustancia
oleosa, que nunca pueden unirse con el agua ya que por ser más liviano
flota sobre el agua.
Otros ejemplos de mezclas heterogéneas : las limaduras de hierro con agua, el arroz con el agua.
Según el estado de los componentes de la mezcla, éstas pueden ser:
Sólido – sólido Ejemplo: Arroz y arena
Sólido – líquido Ejemplo: Piedras y agua
Líquido – líquido Ejemplo: Agua y jugo de limón
Líquido – Gas Ejemplo: Agua y gas carbónico
Gas – Gas Ejemplo: El aire que respiramos.
Procesos para separar mezclas
Las sustancias o componentes que integran una mezcla pueden separarse por métodos como:
Evaporación.- Este proceso separa las
mezclas de sólidos con líquidos. Al colocar la mezcla al fuego, se
calienta el líquido y pasa a estado gaseoso (se evapora) y el sólido
permanece en el fondo del recipiente.
Sedimentación.- Separación de los
componentes de una mezcla de sólidos con líquidos por acción de la
gravedad; en este proceso la sustancia más pesada se precipita o baja al
fondo del recipiente y el líquido se mantiene sobre este.
Magnetismo.- Proceso que separa los
componentes por acción del poder que tienen algunos cuerpos de atraer
metales como el hierro, acero y otro . Recuerda el experimento que
realizamos para separar las limaduras del hierro de la tierra.
Flotación.- En este proceso se
puede dar mezclas entre sólido – líquido o líquido – líquido, en las que
la sustancia menos pesada flota sobre el líquido.
Filtración.- Proceso para separar,
mezclar entre sólido – sólido o sólido – líquido, con la ayuda de un
filtro.- Aparato a través del cual se hace pasar un líquido que se desea
clasificar . O también las partículas pequeñas de un sólido.
Combinaciones
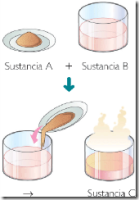 Combinación es la unión de dos o más componentes que forman una nueva
sustancia, en la cual es imposible identificar las características que
tiene los componentes y no se pueden separar usando procedimientos
físicos o mecánicos sencillos. En las combinaciones las sustancias o
componentes que intervienen deben ir en cantidades exactas. Ejemplo: Al
combinarse varios compuestos químicos en cantidades exactas para
fabricar las medicinas. Otros ejemplos de combinaciones. Al quemar una
madera intervienen tanto el aire como el fuego y se producen sustancias
diferentes como son el humo y el carbón en que queda convertida la
madera. Ya no podemos obtener la madera que por acción del fuego se
convirtió en otro elemento, (carbón). Al dejar un objeto de metal en
contacto con agua o humedad en este se forma óxido. Otros ejemplos de
combinaciones son: el agua, el aire, la leche, la sal.
Combinación es la unión de dos o más componentes que forman una nueva
sustancia, en la cual es imposible identificar las características que
tiene los componentes y no se pueden separar usando procedimientos
físicos o mecánicos sencillos. En las combinaciones las sustancias o
componentes que intervienen deben ir en cantidades exactas. Ejemplo: Al
combinarse varios compuestos químicos en cantidades exactas para
fabricar las medicinas. Otros ejemplos de combinaciones. Al quemar una
madera intervienen tanto el aire como el fuego y se producen sustancias
diferentes como son el humo y el carbón en que queda convertida la
madera. Ya no podemos obtener la madera que por acción del fuego se
convirtió en otro elemento, (carbón). Al dejar un objeto de metal en
contacto con agua o humedad en este se forma óxido. Otros ejemplos de
combinaciones son: el agua, el aire, la leche, la sal.
Características de las combinaciones.
Las sustancias que intervienen
pierden sus propiedades. Ej. Luego de quemar un papel; ya no podemos
volver a obtener el papel, este se ha convertido en humo y ceniza. La
cantidad de sustancias que intervienen en las combinaciones es exacta.
Ejemplo: la combinación del aire es : Nitrógeno (N) = 78.08%, Oxígeno
(O2 ) =20.95, Gases raros = 0.97% Las sustancias que intervienen no
pueden separarse por acciones mecánicas o físicas sencillas. Ejemplo:
Una tableta de aspirina no se puede separar en sus compuestos.
|
LEYES DE LAS COMBINACIONES QUÍMICAS (2)
Leyes de las combinaciones químicas
Las hipótesis de los filósofos griegos sobre la
discontinuidad de la materia y su composición por partículas
indivisibles, indestructibles e inmutables, denominadas átomos, se
convirtió en teoría en 1803, gracias a Dalton (1766-1844). Éste se basó
en las experiencias de Boyle (1627-1691) con gases, de Lavoisier
(1743-1794) con combustiones, de Proust (1754-1826) sobre combinaciones
entre los elementos y en las suyas propias. Fruto de estas experiencias
son las leyes fundamentales de las combinaciones químicas, leyes
cuantitativas basadas en la medida de volúmenes de gases y en la pesada
con balanza de sustancias puras y mezclas.
Ley de Lavoisier o de conservación de la masa
Lavoisier enunció la ley de conservación de la masa para
las reacciones químicas, según la cual en todas las reacciones químicas
se cumple que la suma de las masas de los reactivos es igual a la suma
de las masas de los productos.
En la figura se representa la comprobación experimental de la ley de Lavoisier. El carbonato de calcio (CaCO3) se transforma en óxido de calcio (CaO) y dióxido de carbono (CO2) por la acción del calor, sin que varíe la masa durante el proceso.
Ley de Proust o de las proporciones definidas
En 1799, Proust (1754-1826) concluyó que la
composición de una sustancia pura es siempre la misma,
independientemente del modo en que se haya preparado o de su lugar de
procedencia en la naturaleza. Así, por ejemplo, el agua pura contiene
siempre un 11,2% de hidrógeno y un 88,8% de oxígeno.
Según esto, para obtener en el laboratorio 100 gramos
de agua pura hay que hacer reaccionar las cantidades mencionadas. Como
la relación entre oxígeno e hidrógeno es constante en el caso del agua
pura, se puede deducir que:

Este hecho, comprobado en cientos de compuestos, se conoce como la ley de las proporciones definidas y se puede enunciar de dos formas:
- Cuando dos o más elementos químicos se combinan para
formar un determinado compuesto, lo hacen según una relación constante
entre sus masas.
- Cuando un determinado compuesto se separa en sus
elementos, las masas de éstos se encuentran en una relación constante
que es independiente de cómo se haya preparado el compuesto, de si se ha
obtenido en el laboratorio o de su procedencia.
Las consecuencias de esta ley son importantes para la
química, no sólo como método para identificar un compuesto, sino también
para conocer las cantidades de las sustancias que reaccionan entre sí.
Ley de Dalton o de las proporciones múltiples
Dalton comprobó en el laboratorio que, al hacer
reaccionar cobre con oxígeno en diferentes condiciones, se obtenían dos
óxidos de cobre diferentes que, dependiendo de las condiciones, podían
combinarse de forma distinta, pero que sus masas siempre estaban en una
relación de números enteros.
Llegó a la misma conclusión con otros experimentos realizados en el laboratorio y dedujo la ley de las proporciones múltiples,
cuyo enunciado es: las cantidades de un mismo elemento que se combinan
con una cantidad fija de otro para formar varios compuestos, están en
una relación de números enteros sencillos 1:1, 2:1, 1:2, 1:3, 3:1, 2:3,
5:3, etcétera.
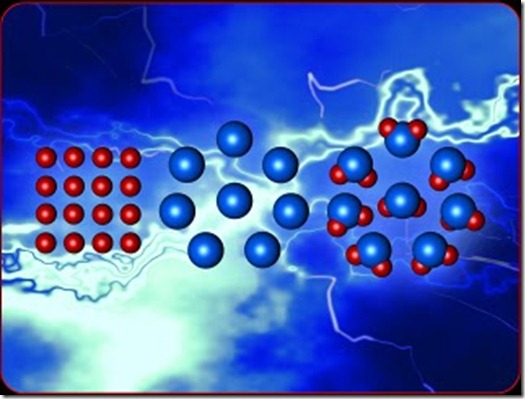
Ley de las proporciones múltiples de Dalton para dos óxidos de cobre.
Ley de Gay-Lussac o de los volúmenes de combinación
Gay-Lussac (1778-1850) observó que al reaccionar un
volumen de oxígeno con dos volúmenes de hidrógeno (esto es, un volumen
doble que el primero), se obtenían dos volúmenes de vapor de agua,
siempre y cuando los volúmenes de los gases se midieran a la misma
presión y temperatura.
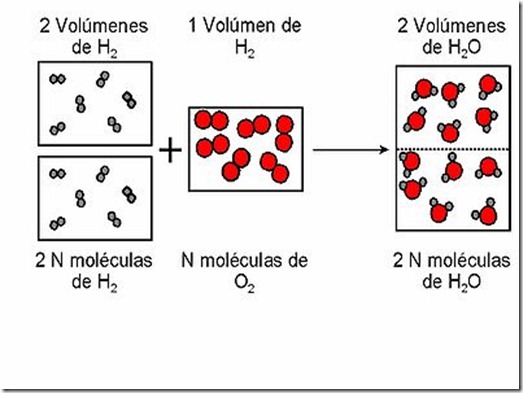
Dispositivo para la medida del volumen del gas desprendido en una reacción.
Según la ley de los volúmenes de combinación
o de Gay-Lussac, en la que intervienen gases, los volúmenes de las
sustancias que reaccionan y los volúmenes de las que se obtienen de la
reacción están en una relación de números enteros sencillos, siempre y
cuando la presión y la temperatura permanezcan constantes.
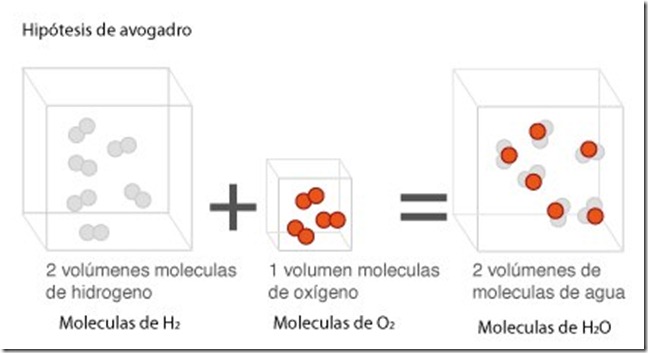
Ley de los volúmenes de combinación aplicada al agua.
|
No hay comentarios:
Publicar un comentario