Reacción endotérmica y exotérmica
Una reacción endotérmica requiere energía mientras que una reacción exotérmica libera energía. Esta clasificación de las reacciones químicas toma en cuenta la participación de la energía bien como reactante o como producto.
La energía es la capacidad para realizar un trabajo o para producir calor. Recordemos que las reacciones químicas involucran una reorganización de los átomos entre sustancias con ruptura o formación de enlaces químicos. Por lo general, esta formación o ruptura de enlaces químicos viene acompañada con cambios en la energía del sistema.
| Reacción endotérmica | Reacción exotérmica | |
|---|---|---|
| Definición | Reacción química donde se absorbe energía. | Reacción química donde se libera energía en forma de calor. |
| Procedencia de la energía | Del entorno | Del sistema |
| Energía potencial | Menor en los reactantes que en los productos. | Mayor en los reactantes que en los productos. |
| Producción | No espontánea | Espontánea |
| Cambio de energía interna | ΔE>0; cambio de energía interna mayor que cero. | ΔE<0; cambio de energía interna menor que cero. |
| Temperatura | Disminuye | Aumenta |
| Ejemplos | Reacciones en la fotosíntesis y síntesis en general. | Una cerilla quemándose, reacciones de combustión. |
¿Qué es una reacción endotérmica?
Una reacción química es endotérmica cuando absorbe energía del entorno. En este caso, el calor se transfiere del exterior al interior del sistema. Cuando colocamos un termómetro mientras se produce la reacción endotérmica, la temperatura disminuye.
La palabra "endotérmica" deriva del griego endon que significa "dentro" y therme que significa "calor". Las reacciones endotérmicas no proceden de forma espontánea.
¿De dónde proviene la energía en las reacciones endotérmicas?
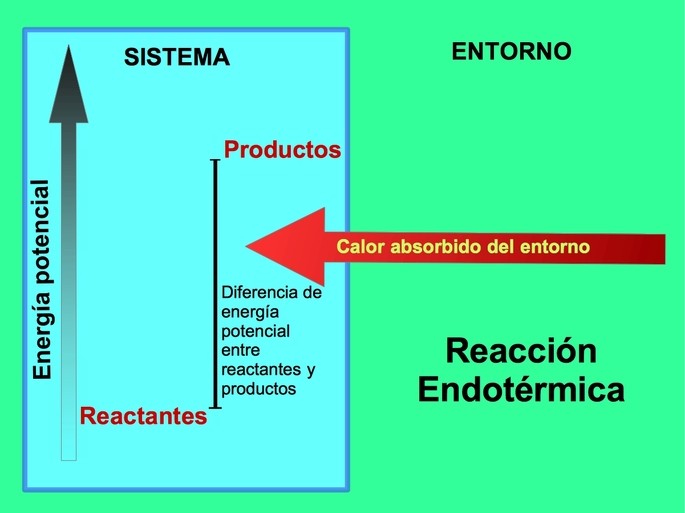
En las reacciones endotérmicas la energía procede del entorno fuera del sistema. La cantidad de energía potencial de los productos es mayor que la energía potencial de los reactantes. Por eso, se requiere adicionar energía a los reactantes para que la reacción proceda. Esta energía procede del calor del entorno.
Por ejemplo, la fotosíntesis es un proceso endotérmico, donde las plantas captan la energía solar para producir glucosa a partir del dióxido de carbono y el oxígeno:
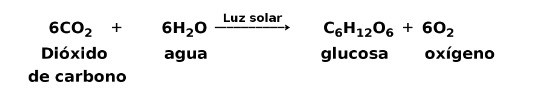
Los productos de la reacción de fotosíntesis, glucosa y oxígeno, poseen mayor cantidad de energía potencial con respecto a los reactantes, dióxido de carbono y agua. Otros ejemplos de reacciones químicas endotérmicas con la cantidad de energía utilizada:

Ejemplos de reacción endotérmica
No sólo en el laboratorio de química se producen reacciones. En el día a día también encontramos situaciones donde se presentan reacciones endotérmica.
Cocción de los alimentos
Aunque no lo parezca, el proceso de cocinar los alimentos es endotérmico. Para poder consumir ciertos alimentos, debemos proporcionar calor.
Bolsa fría instantánea
Las bolsas frías que se usan para tratar golpes o torceduras están llenas de agua, pero cuando se agitan o golpean, se rompe en su interior una capsula que contiene nitrato de amonio. La mezcla de nitrato de amonio con agua es una reacción endotérmica, lo que hace que se enfríe la bolsa.
¿Qué es una reacción exotérmica?
Una reacción exotérmica es aquella donde la energía fluye hacia afuera del sistema. Esta energía se libera en forma de calor, por lo que al colocar un termómetro en el sistema de reacción la temperatura aumenta.
La palabra "exotérmica" se forma por exo que significa "hacia afuera" y thermes, que significa "calor". Las reacciones exotérmicas pueden presentarse de forma espontánea y, en algunos casos, ser explosivas, como la combinación de metales alcalinos y agua.
¿De dónde proviene la energía en las reacciones exotérmicas?
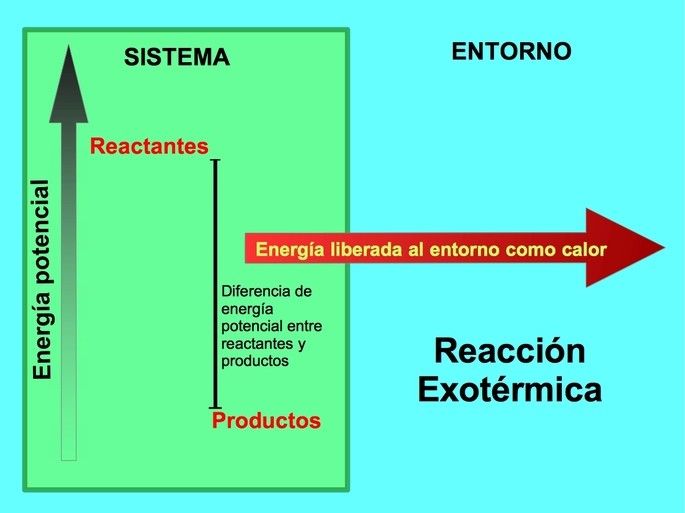
En una reacción química, los reactantes son los compuestos que se transforman y dan origen a los productos. Por ejemplo, cuando reacciona sodio Na con cloro Cl, estos son los reactantes y el producto es el cloruro de sodio NaCl:
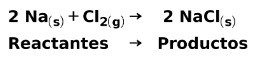
Tanto reactantes como productos poseen una energía potencial almacenada. Sabemos por la ley de conservación de la energía que la energía no se pierde ni se gana, así que la energía de los reactantes debe ser igual a la de los productos
En una reacción exotérmica, los reactantes poseen más energía potencial en comparación con los productos, por lo que el exceso de energía se libera en forma de calor. En este caso, la energía también es considerada como parte de los productos:

En cualquier proceso exotérmico, parte de la energía potencial almacenada en los enlaces químicos se convierte en energía térmica por medio del calor.
Ejemplos de reacción exotérmica
El detergente para lavar ropa

Cuando disolvemos un poco de detergente en polvo con agua en la mano podemos sentir un leve calentamiento.
Combustión del gas doméstico

La combustión de gases para uso doméstico, como el metano o el butano, involucra la reacción química con oxígeno con la formación de dióxido de carbono y agua, y liberación de energía. Esta es una típica reacción exotérmica de uso cotidiano:
La energía liberada en el proceso de combustión la usamos para cocinar los alimentos.
Te puede interesar también conocer qué son Sistema abierto, sistema cerrado y sistema aislado.
TAREA
1. LEA LA PAGINA 136 DEL TEXTO Y REALICE UN MAPA CONCEPTUAL
2. REALICE LAS ACTIVIDADES DE LA PÁGINA 135 EN UNA HOJA PERFORADA.
3. AGRADEZCO LAS TAREAS ENVIADAS PARA SU EVALUACIÓN. MÁXIM0 EN DOS DÍAS LE ESTARÉ ENVIANDO QUE HE RECIBIDO.SI NO ES ASÍ ENVIAR DE NUEVO. HASTA AHORA NO HAN NINGÚN PROBLEMA. SALUDOS CORDIALES Y RECUERDE "QUÉDESE EN CASA"
No hay comentarios:
Publicar un comentario