Qué es el mol?
El mol es una de las magnitudes estipuladas por el Sistema Internacional de Unidades (SI). Su símbolo es “mol”
El mol es definido como la cantidad de materia que contiene determinado número de entidades elementales (átomos, moléculas, etc) equivalente a la cantidad de átomos que hay en 12 gramos del isótopo carbono-12 (12C).
La masa de un mol de sustancia (llamada masa molar) es equivalente a la masa atómica o molecular (según se haya considerado un mol de átomos o de moléculas) expresada en gramos.
El número de Avogadro (NA) es la cantidad de partículas ( moléculas, átomos, electrones) que contiene un mol de una sustancia cualquiera. Es una constante que corresponde al valor de 6,022×10^23 mol-1. Por tanto, 1 mol de cualquier sustancia contiene 6,022×10^23 entidades elementales de esa sustancia. Por otra parte, el número de Avogadro permite establecer conversiones entre el gramo y la unidad de masa atómica, siendo 6,022×10^23 u.m.a (unidad de masa atómica) igual a 1 gramo. El número de Avogadro es la cantidad de átomos que contiene 1 mol de átomos cuya masa es igual a la masa atómica del elemento.
[embedyt]https://www.youtube.com/watch?v=6aGsqw0ZX5A[/embedyt]
Ver además: Calor específico
¿Cómo se calcula el mol?

Para calcular los moles es necesario conocer la masa atómica o la molecular, dependiendo de si se trata de átomos o compuestos respectivamente. Entonces, para calcular el número de moles de moléculas o átomos de una sustancia cualquiera debe realizarse la fracción entre la masa de la sustancia, sobre su masa molecular o atómica. Por ejemplo, si queremos calcular el número de moles de X escribimos:
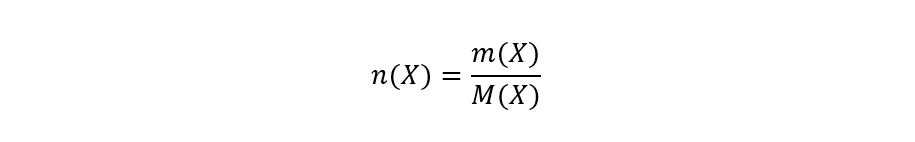
Donde: es el número de moles de X, m(X) es la masa de X y M(X) es la masa atómica o molecular de X.
TAREA
IGUALE Y COLOQUE EL NÚMERO DE MOLES Y SUS MASAS
a. N2 (g) + O2 (g) NO2 (g)
b. HCl (aq) + Zn(OH)2 (s) ZnCl2 (aq) + H2O (l)
c. C2H5OH (l) + O2 (g) CO2 (g) + H2O (l)
d. HgO (s) Hg (l) + O2 (g)
e. H2O2 (l) H2O (l) + O2 (g)
f. Zn (s) + H2SO4 (aq) ZnSO4 (aq) + H2 (g)
No hay comentarios:
Publicar un comentario