Distribución electrónica
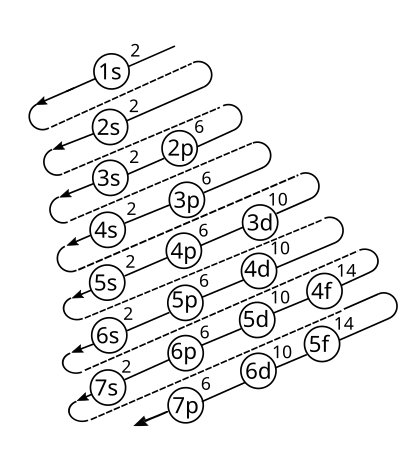
Es la distribución de los electrones en los subniveles y orbitales de un átomo. La configuración electrónica de los elementos se rige según el diagrama de Moeller:
Para comprender el diagrama de Moeller se utiliza la siguiente tabla:
| s | p | d | f | |
|---|---|---|---|---|
| k = 1 | 1s | |||
| l = 2 | 2s | 2p | ||
| m = 3 | 3s | 3p | 3d | |
| n = 4 | 4s | 4p | 4d | 4f |
| o = 5 | 5s | 5p | 5d | 5f |
| p = 6 | 6s | 6p | 6d | 6f |
| q = 7 | 7s | 7p | 7d | 7f |
Para encontrar la distribución electrónica se escriben las notaciones en forma diagonal desde arriba hacia abajo y de derecha a izquierda (seguir colores):
| 1s | 2s | 2p 3s | 3p 4s | 3d 4p 5s | 4d 5p 6s | 4f 5d 6p 7s | 5f 6d 7p |
Este principio de construcción (denominado principio de Aufbau, del alemán Aufbau que significa 'construcción') fue una parte importante del concepto original de Bohr de configuración electrónica. Puede formularse como:7
- sólo se pueden ocupar los orbitales con un máximo de dos electrones, en orden creciente de energía orbital: los orbitales de menor energía se llenan antes que los de mayor energía.
Así, vemos que se puede utilizar el orden de energías de los orbitales para describir la estructura electrónica de los átomos de los elementos. Un subnivel s se puede llenar con 1 o 2 electrones. El subnivel p puede contener de 1 a 6 electrones; el subnivel d de 1 a 10 electrones y el subnivel f de 1 a 14 electrones. Ahora es posible describir la estructura electrónica de los átomos estableciendo el subnivel o distribución orbital de los electrones. Los electrones se colocan primero en los subniveles de menor energía y cuando estos están completamente ocupados, se usa el siguiente subnivel de energía superior. Esto se puede representar por la siguiente tabla:
| s | p | d | f | |
|---|---|---|---|---|
| n = 1 | 2 | |||
| n = 2 | 2 | 6 | ||
| n = 3 | 2 | 6 | 10 | |
| n = 4 | 2 | 6 | 10 | 14 |
| n = 5 | 2 | 6 | 10 | 14 |
| n = 6 | 2 | 6 | 10 | |
| n = 7 | 2 | 6 |
Para encontrar la configuración electrónica se usa el mismo procedimiento anterior incluyendo esta vez el número máximo de electrones para cada orbital.
| 1s2 | 2s2 | 2p6 3s2 | 3p6 4s2 | 3d10 4p6 5s2 | 4d10 5p6 6s2 | 4f14 5d10 6p6 7s2 | 5f14 6d10 7p6 |
Finalmente la configuración queda de la siguiente manera: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Para determinar la configuración electrónica de un elemento, basta con calcular cuántos electrones hay que acomodar y entonces distribuirlos en los subniveles empezando por los de menor energía e ir llenando hasta que todos los electrones estén distribuidos. Un elemento con número atómico mayor tiene un electrón más que el elemento que lo precede. El subnivel de energía aumenta de esta manera:
- Subnivel s, p, d o f: Aumenta el nivel de energía.
Sin embargo, existen excepciones, como ocurre en los elementos de transición al ubicarnos en los grupos del cromo y del cobre, en los que se promueve el electrón dando así una configuración fuera de lo común.
No hay comentarios:
Publicar un comentario